您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-18 10:19
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
甘莱FXR激动剂早期临床结果积极。甘莱制药非酒精性脂肪性肝炎(NASH)候选药物FXR激动剂ASC42在美国I期临床中取得良好的安全性和药效学生物标志物顶线数据。在为期14天、每日一次、每次15mg的治疗过程中,FXR靶向激活的生物标志物FGF19相较于给药前分别在第1天和第14天显示出1195%和1632%的增幅;FXR靶向激活的生物标志物C4相较于基线分别在第1天和第14天显示出88%和93%的降幅。目前,这一剂量已被确定为II期试验中的三个剂量之一,该试验将于年底前启动。
国内药讯
1.君实生物EGFR靶向新药启动I/II期临床。君实生物旗下君境生物登记启动一项EGFR-exon20抑制剂JS111(AP-L1898)用于治疗局部晚期或转移性非小细胞肺癌(NSCLC)的I/II期临床。该项临床由上海市肺科医院周彩存医学博士担任主要研究者。在临床前研究中,JS111保持了抑制T790M等EGFR常见变异的活性和对野生型EGFR的选择性,而且还克服了第三代EGFR抑制剂对exon 20插入等EGFR非常见突变的不敏感。
2.普克鲁胺治疗新冠III期临床在巴西获批。开拓药业普克鲁胺获巴西药监部门ANVISA批准,即将于7月开展用于治疗轻中症新冠男性患者的III期临床。这是继FDA同意开展两项III期临床试验之后,普克鲁胺治疗新冠的第三项III期临床试验。这是一项全球多中心的III期临床,旨在探索普克鲁胺治疗轻中症新冠男性患者的效果。临床主要终点为28天内需吸氧的受试者百分比。
3.石药又一ADC品种获批临床。石药集团巨石生物1类新药SYSA1801注射液获CDE临床试验默示许可,拟用于晚期实体瘤的治疗。SYSA1801是一款CLDN18.2靶向抗体偶联药物(ADC),也是石药申报的第2款ADC产品。在临床前研究中,SYSA1801能有效通过抗Claudin-18.2抗体靶向肿瘤细胞并发生内吞,将MMAE毒素带入肿瘤细胞而起到治疗胃癌和胰腺癌的作用。FDA已授予SYSA1801用于胃癌及胃食管交界处癌的孤儿药资格。
4.贝达CDK4/6抑制剂获批临床。贝达药业1类新药BPI-16350胶囊获国家药监局两项临床试验默示许可,拟联合氟维司群或芳香化酶抑制剂用于治疗乳腺癌。BPI-16350是该公司自主开发的一款CDK4/6抑制剂,拟开发单药或与激素疗法联用治疗HR+/HER2-、晚期或转移乳腺癌患者,也可用于Rb+的其他癌症的一、二线或联合治疗。此前,BPI-16350已在国内获批针对实体瘤的临床研究,目前该项Ⅰ期研究正在进行中。
5.翰森制药联手鱼鹰资产创立博胜药业。翰森制药和鱼鹰资产共同创立并孵化的博胜药业日前成立。博胜药业致力于为更多中国患者带来潜在的突破性治疗药物,目前已完成由翰森制药和鱼鹰资产两家公司共同领投的7200万美元 A轮融资。翰森制药将为博胜药业提供临床前、临床和商业化支持,以加快产品管线在中国的研发和上市。鱼鹰资产董事总经理、C4 Therapeutics前CEO Andrew Phillips博士出任博胜药业的代理CEO。
国际药讯
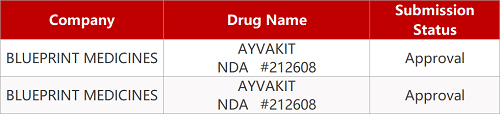
1.靶向KIT抑制剂获FDA扩展适应症。FDA批准Blueprint Medicines小分子D816V靶向KIT抑制剂Ayvakit(avapritinib)治疗晚期系统性肥大细胞增多症(advanced SM)成人患者,包括侵袭性SM(ASM)、伴有血液肿瘤的SM(SM-AHN)和肥大细胞白血病(MCL)。Ayvakit也是晚期SM患者获批的首款靶向疗法。此前,FDA已批准该新药用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的胃肠道间质瘤(GIST)患者。基石药业拥有avapritinib在大中华区临床开发和推广的权益。
2.礼来治疗偏头痛药物启动Ⅳ期临床。礼来宣布其CGRP单抗Emgality(注射剂,每月皮下注射一次)将开展一项Ⅳ期研究,评估与Biohaven公司CGRP拮抗剂Nurtec ODT(口腔崩解片,每隔一天服用一次)对比用于治疗有或无先兆的发作性偏头痛(EM)患者的疗效。研究主要终点是每月偏头痛天数减少50%的患者比例。据悉,这项研究是首个比较2种CGRP靶向药物的头对头临床试验。
3.辉瑞托法替尼治疗新冠Ⅲ期临床有戏。辉瑞JAK抑制剂tofacitinib(托法替尼)治疗COVID-19住院患者的Ⅲ期STOP-COVID研究的阳性结果发表于《新英格兰医学杂志》上。与安慰剂组(29.0%)相比,托法替尼组(18.1%)在28天内的累计死亡或呼吸衰竭发生率较低(风险比[RR]=0.63;95%CI:0.41-0.97;p=0.04)。托法替尼组全因死亡率为2.8%,安慰剂组为5.5%(危险比[HR]=0.49;95%CI:0.15-1.63)。两组严重感染发生率分别为3.5%和4.2%。
4.再生元新冠抗体鸡尾酒Ⅲ期临床积极。再生元(Regeneron)新冠中和抗体鸡尾酒疗法REGEN-COV(casirivimab和imdevimab)在Ⅲ期临床RECOVERY中获积极结果。试验结果表明,在本身没有对新冠病毒产生天然抗体应答的COVID-19住院患者中,相比对照组,在常规护理的基础上加用REGEN-COV能够使患者死亡风险降低20%。再生元计划尽快与监管机构展开讨论,并要求FDA扩大紧急使用授权(EUA)以纳入适当的住院患者。
5.渤健tau抗体治疗AD的Ⅱ期临床失败。渤健tau抗体Gosuranemab (BIIB092)的Ⅱ期TANGO研究最新结果公布。在阿尔茨海默病(AD)导致的轻度认知障碍患者中,与安慰剂相比,该新药在第78周的临床痴呆评定量表-框总和(CDR-SB)中未达到主要疗效终点;在阿尔茨海默病评估量表-认知分量表 (ADAS-Cog 13)、阿尔茨海默病日常生活合作研究活动(ADCS-ADL)、简易精神状态检查(MMSE)等探索性疗效终点方面未发现治疗获益。Gosuranemab总体耐受性良好,安全性结果与之前研究一致。
6.Umoja募资加速开发体内CAR-T细胞疗法。Umoja Biopharma完成2.1亿美元的B轮融资,用于加速推进其体内基因工程CAR-T细胞免疫疗法的开发。Umoja公司用于治疗实体瘤和血液系统恶性肿瘤的新一代整合免疫疗法技术平台,可以直接改造患者体内免疫细胞,使患者的免疫细胞可以直接识别并攻击肿瘤细胞。据悉,该平台由三个核心组件互补发挥作用:VivoVec体内递送平台、RACR/CAR体内细胞扩增/控制平台和TumorTag靶向分子平台。
医药热点
1.十项举措将便利老年人就医。国家卫健委发布《关于实施进一步便利老年人就医举措的通知》,聚焦老年人反映突出的就医问题,推出了便利老年人就医的十项举措。这十项举措为:设立老年人快速预检通道,提供多渠道预约挂号服务,便利的药事服务,优化线上线下服务流程,安排专人提供导医服务,构建适老化就医环境,推动老年人居家医疗服务,推行出入院一站式服务,加强住院老年患者管理,加强对老年人运用智能技术就医的宣传引导。
2.公立医院改革第二批示范城市名单出炉。国家卫健委发布《关于确定公立医院综合改革第二批国家级示范城市的通知》,将17个城市确定为公立医院综合改革第二批国家级示范城市。这17个城市分别是:天津市、太原市、赤峰市、大连市、齐齐哈尔市、恩施土家族苗族自治州、湘潭市、柳州市、三亚市、重庆市永川区、自贡市、遵义市、拉萨市、西宁市、中卫市、克拉玛依市、新疆生产建设兵团第八师。
3.6项医疗费用拟不纳入医保。国家医保局发布《医疗保障法(征求意见稿)》向社会公开征求意见。《意见稿》提出六项医疗费用不纳入基本医保基金支付范围,即应当从工伤保险基金中支付的;应当由第三人负担的;应当由公共卫生负担的;在境外就医的;体育健身、养生保健消费、健康体检;国家规定的基本医疗保险基金不予支付的其他费用。
审评动向
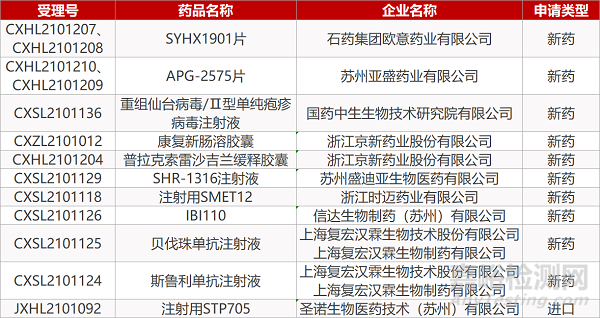
1. CDE新药受理情况(06月17日)
申请临床:
石药集团欧意药业的SYHX1901片(2个规格)、苏州亚盛的APG-2575片(2个规格)、国药中生的重组仙台病毒/Ⅱ型单纯疱疹病毒注射液、浙江京新的康复新肠溶胶囊和普拉克索雷沙吉兰缓释胶囊、苏州盛迪亚的SHR-1316注射液、浙江时迈的注射用SMET12、信达生物的IBI110、上海复宏汉霖的贝伐珠单抗注射液和斯鲁利单抗注射液、圣诺生物的注射用STP705
申请生产:
2. FDA新药获批情况(北美06月16日)

来源:药研发


