您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-25 12:04
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
劲方医药GFH018上实体瘤国际临床。劲方医药TGF-β R1抑制剂GFH018治疗晚期实体瘤的国际Ib/II期临床在澳大利亚完成首例患者给药。该项研究主要评估GFH018与PD-1特瑞普利单抗联合用药的安全性/耐受性,以及GFH018的药代动力学特征和联合用药的疗效。在I期单药临床试验中,GFH018已显示出良好的药物安全性;在临床前动物实验中,GFH018与PD-1抑制剂联用达到协同增效作用。
国内药讯
1.诺华CDK4/6抑制剂在华报NDA。诺华CDK4/6抑制剂琥珀酸利柏西利片(曾用名:琥珀酸瑞波西利片)上市申请获国家药监局受理。利柏西利(ribociclib)最早于2017年3月在美国获批上市,商品名为Kisqali,目前已获批:与芳香化酶抑制剂联用治疗绝经前/围绝经期以及绝经后HR+/HER2-晚期或转移性女性乳腺癌患者;与氟维司群联用作为初始内分泌治疗或用于初始内分泌治疗失败疾病进展的HR+/HER2-晚期或转移性女性乳腺癌患者。
2.恒瑞又一ADC品种启动国际临床。恒瑞医药ADC新药SHR-A2009登记启动一项国际多中心I期临床。这项临床试验由广东省人民医院的吴一龙教授和周清教授担任主要研究者,计划在国内入组100人,国际入组132人,评估注射用SHR-A2009在晚期实体瘤患者中的安全性、耐受性、药代动力学及疗效。据悉,恒瑞目前已有7个ADC项目,其中5款已经启动临床试验。
3.凯思凯迪新型FXR激动剂获批临床。凯思凯迪1类新药CS0159口服片剂获FDA临床默示许可,将针对原发性硬化性胆管炎(PSC)在美国开展临床研究。CS0159是一种新型FXR小分子激动剂,由上海药物所徐华强课题组和李佳课题组联合自主研发。临床前研究表明,CS0159具有强效的FXR激动活性及肝靶向分布的特点,可明显改善3,5-二乙氧基羰基-1,4-二氢三甲基吡啶诱导的小鼠PSC模型的病理状况,而且起效剂量低、药效显著且耐受性良好。
4.复星Bcl-2抑制剂获批临床。复星医药旗下复创医药1类新药FCN-338片获国家药监局临床试验默示许可,将开展用于治疗复发或难治性B细胞淋巴瘤的I期临床研究。FCN-338是复星医药自主研发的Bcl-2选择性小分子抑制剂。BCL-2在细胞凋亡中发挥重要作用,且在某些类型癌症中过度表达,与耐药的形成相关,是血液癌症治疗的一个新靶标。该药用于血液系统恶性肿瘤治疗的临床申请去年已分别获NMPA和FDA批准。
5.诺华SMA基因疗法在国内报IND。诺华SMA基因疗法Zolgensma(OAV101)的临床试验申请获CDE受理。Zolgensma是诺华开发的一款针对脊髓性肌萎缩症(SMA)的基因疗法,单次静脉注射便可实现持续的SMN蛋白表达以阻止疾病进展,已于2019年5月获FDA批准上市。在2021年美国处方药搜索平台GoodRx公布的药物价格中,Zolgensma以212.5万美元(约合1380万元)的价格高居榜首。该药2020年销售额为9.2亿美元。
6.君实/恩瑞尼CD39单抗报IND。君实与恩瑞尼联合开发的新型CD39单抗S019注射液的临床试验申请获CDE受理。与其他CD39靶向产品相比,JS019在工艺设计中增强了抗体依赖的细胞毒作用(ADCC),可以直接靶向CD39高表达的肿瘤新生血管内皮细胞和肿瘤相关巨噬细胞(TAMs),从而用于治疗晚期恶性肿瘤。S019是国内首个申报临床的CD39单抗。
国际药讯
1.FDA发布真实世界数据使用指南。FDA日前发布指南草案,对真实世界数据的收集、转化和递交给出指导意见。FDA强调药企在整理真实世界数据并将它们转化为FDA可以接受的格式时,应记录下对源数据进行增添、删除、或者改变的所有步骤。FDA鼓励使用真实世界数据支持监管申请的药企尽早与FDA进行讨论,阐明对真实世界数据处理方法的理论基础,处理方式,数据管理计划,以及最终报告形式。
2.罗氏创新眼部给药系统获FDA批准。罗氏开发的、可以在长达数月里持续释放抗VEGF抗体雷珠单抗的眼部给药系统Susvimo获FDA批准上市,用于治疗既往接受过至少两种抗血管内皮生长因子(VEGF)注射治疗的湿性年龄相关性黄斑变性(AMD)患者。Susvimo大小与一粒米粒相当,用于植入患者眼中定期补充雷珠单抗。在一项Ⅲ期临床中,Susvimo系统和每月接受雷珠单抗眼内注射治疗相比,达到并且维持相同的视力改善。
3.两款PVC获美国CDC支持。美国疾控中心(CDC)免疫实践咨询委员会(ACIP)宣布支持辉瑞的Prevnar 20和默沙东的Vaxneuvance做为常规免疫接种,用于预防由肺炎链球菌引起的相关侵袭性疾病。辉瑞的注射剂Prevnar 20有潜力预防20种血清型肺炎,而默沙东的注射剂则可预防15种。CDC专家建议这两款疫苗,适用于以前未接种过肺炎球菌结合疫苗的65岁及以上患者,以及具有某些风险因素的19至64岁人群。
4.辉瑞/BioNTech新冠疫苗加强针效果积极。辉瑞与BioNTech联合开发的COVID-19疫苗tozinameran(BNT162b2 )用于第3剂加强的III期结果公布。与未接种加强针受试者相比,2剂疫苗后接种第3剂的受试者观察到的疫苗相对有效性为95.6% (95% CI: 89.3, 98.6);而且不论年龄、性别、种族、民族或共病情况,受试者的疫苗疗效一致。FDA已授予tozinameran紧急使用授权,在两剂疫苗接种六个月后用于第3剂加强接种,或在符合条件人群中“混打”增强接种。
5.Dupixent治疗结节性痒疹Ⅲ期临床积极。再生元与赛诺菲联合开发的IL-4/IL-13单抗度普利尤单抗注射液(dupilumab,Dupixent),在治疗结节性痒疹患者的关键性Ⅲ期临床达到主要和所有关键性次要终点。与安慰剂相比,dupilumab治疗组第12周时瘙痒减轻的患者比例更多(37%vs22%,p=0.0216);第24周时,两组的这一数值分别为58%和20%(p<0.0001),两组达到光洁或几乎光洁皮肤的患者比例分别为45%和16%(p<0.0001)。临床中,安全性结果与已知研究一致。
6.创新儿科基因疗法早期临床积极。Rocket公司基因疗法RP-L201治疗白细胞黏附缺陷症I型(LAD-I)的Ⅰ/Ⅱ期临床结果积极。LAD-I是一种罕见的常染色体隐性儿科疾病,由编码β-2整合素成分CD18的ITGB2基因突变引起。中期数据显示,所有患者均显示初步疗效,其中2例患者随访至少12个月;7例患者显示出持久的中性粒细胞CD18表达,显著超过与存活到成年相关的4-10%的阈值;而且临床中无药物相关SAE事件发生。
7.Egle公司完成A轮融资。Egle Therapeutics公司宣布完成4000万欧元(约4640万美元)的A轮融资。Egle Therapeutics成立于2020年初,该公司的研发平台基于矢量计算修改IL-2蛋白,旨在开发用靶向调节性T细胞(Tregs)的潜在“first-in-class”免疫疗法,用于治疗癌症和自身免疫性疾病。去年6月,Egle与武田达成战略研究合作,联合开发创新Treg靶标潜在疗法。
医药热点
1.香港将放宽引入海外专科医生限制。香港特区政府将就《2021年医生注册(修订)条例草案》作出3项修订,将允许符合资格、非本地培训的非香港永久性居民医生参与特别注册,以申请在香港执业;容许具有香港永久性居民资格、尚未开展实习的非本地医科毕业生直接参加香港的执业资格考试;为具备专科资格的有限度注册医生提供衔接安排,以加入特别注册制度。
2.华西医院高级实践护士项目启动。四川大学华西医院高级实践护士(APN)项目于10月21日正式启动。华西医院首批将在外科、内科、肿瘤科设立30个高级实践护士岗位。高级实践护士在做好传统护理的基础上,还将开展一些原来由医生开展的工作,旨在提高医疗质量,加快患者的康复速度。
3.第十三届“谈家桢生命科学奖”揭晓。10月23日,第十三届“谈家桢生命科学奖”颁奖典礼在中山大学举行。本届共有17位科学家获奖。其中,香港科技大学生命科学部嘉里理学教授张明杰院士、中科院上海药物所药物靶标结构与功能中心主任徐华强获得“谈家桢生命科学成就奖”;首都医科大学附属北京天坛医院院长王拥军、清华大学附属北京清华长庚医院院长董家鸿院士、浙江大学医学院附属邵逸夫医院院长蔡秀军获得“谈家桢临床医学奖”。
评审动态
申请临床:
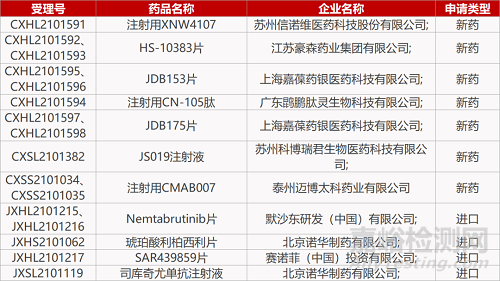
苏州信诺维医药的注射用XNW4107、江苏豪森的HS-10383片(2个规格)、上海嘉葆药银医药的JDB153片(2个规格)和JDB175片(2个规格)、广东鹍鹏肽灵生物的注射用CN-105肽、苏州科博瑞君生物的JS019注射液、默沙东的Nemtabrutinib片(2个规格)、赛诺菲的SAR439859片、诺华的司库奇尤单抗注射液。
申请生产:
泰州迈博太科药业的注射用CMAB007(2个规格)、诺华的琥珀酸利柏西利片

来源:药研发


