您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2021-12-15 22:28
疫情仍未散去,奥密克戎毒株使全球再一次坠入难题,人类的交往方式被前所未有的颠覆,时代车轮挟雨伴雪般的滚滚赴前,人类在巨变的光束里相依而动,把孤岛连城大陆,把边缘聚拢。
对于医疗行业,能让人胆怯的,既是未来也不是未来,黄金十年被存活所替代,稳定与安全护持着产业之轨飘扬,争论真切又魔幻,哪里都是变局。2021的回顾与盘点,赛柏蓝器械将从今天开始徐徐展开...
心血管类企业独占鳌头
2021年进入国家级创新器械审批程序的产品中,超过三分一为心血管类医疗器械,国产产品约占90%。
什么是创新医疗器械特别审查程序?
国家药监局指出:为贯彻实施《医疗器械监督管理条例》《国家创新驱动发展战略》,贯彻落实国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和国务院《关于改革药品医疗器械审评审批制度的意见》,国家药监局实施创新医疗器械特别审批程序,鼓励医疗器械研发创新,2014年2月7日,原国家食品药品监督管理总局发布了《创新医疗器械特别审批程序(试行)》,自2014年3月1日起施行。
针对具有我国发明专利、技术上具有国内首创、国际领先水平,并且具有显著临床应用价值的医疗器械设置特别审批通道。该程序的实施对医疗器械研发创新、新技术推广应用、产业高质量发展起到了积极推动作用。
新修订的《创新医疗器械特别审查程序》完善了适用情形、细化了申请流程、提升了创新审查的实效性、完善了审查方式和通知形式,并明确对创新医疗器械的许可事项变更优先办理。修订的《创新医疗器械特别审查程序》,有利于提升创新医疗器械审查效率,为鼓励医疗器械产业创新发展发挥积极作用。
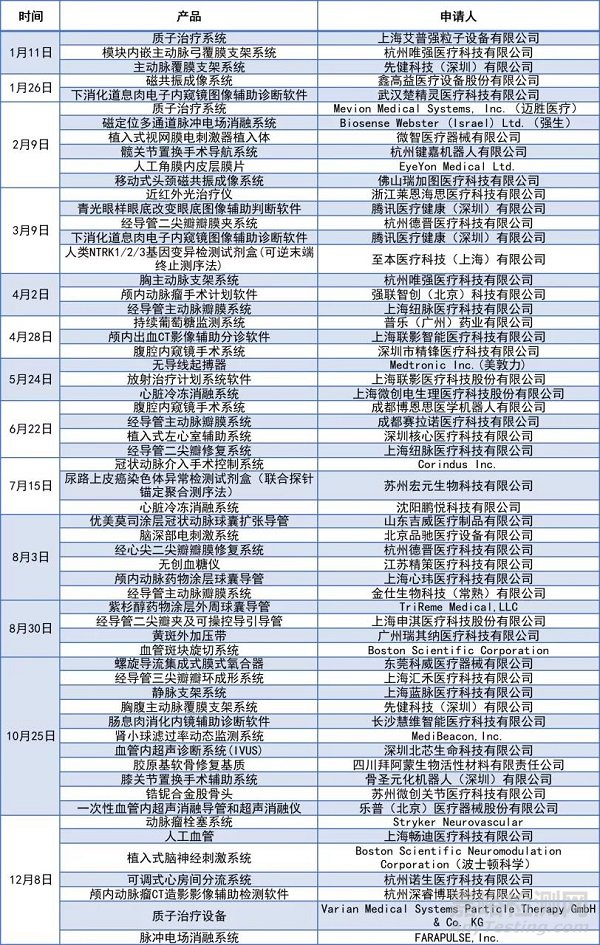
据众成医械研究院提供的数据,今年截至12月8日,进入国家级创新医疗器械产品特别审批程序项目数量共60件,相较2020年的53件有一定提升。
产品核心技术是关键
创新医疗器械特别审查程序中有关专利的方面有哪些要求?
创新医疗器械的审查条件之一就是申请人在中国依法拥有产品核心技术发明专利权。考虑存在核心技术发明专利的申请已由国务院专利行政部门公开,但最终未被授予专利权的情况,因此增加对产品核心技术方案的预评价。
国家知识产权局专利检索咨询中心是国家知识产权局直属单位,申请人可向专利检索咨询中心提出检索申请。为进一步鼓励创新,激发医疗器械生产企业的研发活力,考虑到专利的特点与医疗器械研发的平均周期,因此,确定创新医疗器械特别审查申请时间距专利授权公告日不超过5年。
据众成医械统计,今年以来共有33件国家级创新医疗器械获批上市,而2020年获批数量为26件。从数量情况看,北京市、江苏省、广东省均为7件并列全国第一,占全国数量三分之二以上。在获批的产品当中有不少产品在全球范围内实现了技术“无人区”的突破,却面临着用户不信任、国际同行挤压市场等窘境。临床应用是医疗器械创新商业变现的最终途径,但如何直面国际龙头企业的竞争,改变多年临床使用习惯仍然是众多创新医疗器械面临的挑战。
11月9日,国家药监局依照《创新医疗器械特别审查程序》,批准生物疝修补补片上市。这是自2014年设置“创新医疗器械特别审查通道”以来,批准上市的第130个创新医疗器械。
创新医疗器械是具有我国发明专利,技术上属于国内首创、国际领先,具有显著临床应用价值的医疗器械,2022年,会有哪些器械继续获批,共同拭目以待。

来源:赛柏蓝器械


