您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-02-16 22:45
FDA医疗器械与放射健康中心(CDRH)于近期发布了年度报告,本文节选自报告中器械创新部分
CDRH 愿景是推动更安全、更有效的新型医疗器械的创新,并解决未满足的医疗需求。在2021 年,CDRH以多种显著方式完成了对创新的承诺。
在2021年里:
1、13个被指定为突破性器械的提交获得 FDA 上市授权;
2、103个新型医疗器械(novel device)获得了FDA的上市授权;
3、收到213个被指定为突破性器械的提交;
4、自2015年计划开始以来,收到617个被指定为突破性器械的提交。
新型医疗器械
新技术包括通过PMA、HDE 和 De Novo 途径推向市场,以及部分通过紧急使用授权 (EUA) 或突破性器械计划推向市场的技术。这些技术解决了未满足的需求,可能比当前可用的替代方案更安全或更有效。
在过去十年中,由于 CDRH 制定和实施了创新政策和方法,使用创新技术的医疗器械批准、授权和许可数量增加了四倍。2021 年,CDRH 授权了 103 种新型器械的上市许可。
获得上市授权的新型医疗器械案例:
1、冲击波血管内碎石术 (IVL) 系统
SHOCKWAVE INTRAVASCULAR LITHOTRIPSY (IVL) SYSTEM
用于在支架置入前对严重钙化、从头狭窄的冠状动脉进行碎石、低压球囊扩张。
安全和有效性数据综述(SSED):

相关链接:
https://www.accessdata.fda.gov/cdrh_docs/pdf20/P200039B.pdf
2、PAIGE PROSTATE.
第一个基于人工智能 (AI) 旨在识别前列腺活检图像上最有可能患有癌症区域的软件,如果在初次检查时尚未注意到该区域,则病理学家可以进一步检查该区域。
授权公告:
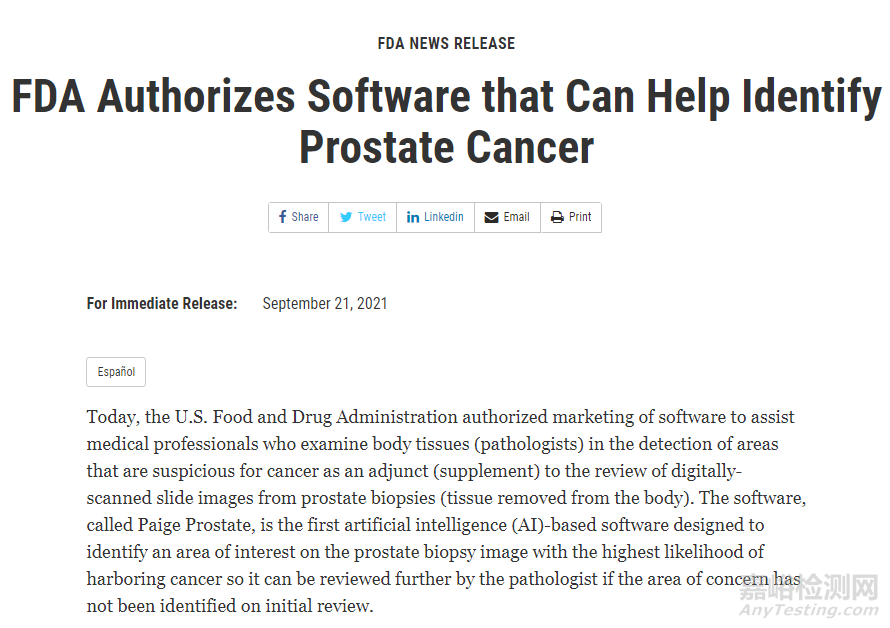
相关链接:
https://www.fda.gov/news-events/press-announcements/fda-authorizes-software-can-help-identify-prostate-cancer
3、GI GENIUS
一种使用基于机器学习的人工智能来帮助临床医生在结肠镜检查期间实时检测病变(如息肉或疑似肿瘤)的器械。
De Novo:
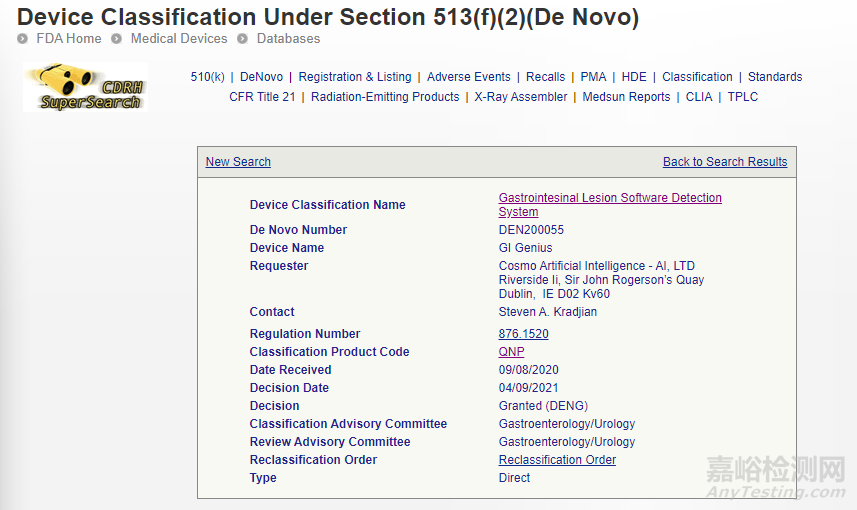
相关链接:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpmn/denovo.cfm?id=DEN200055
4、患者专用距骨垫片
世界上以及同类第一个3D打印植入物,用于替代距骨治疗踝关节缺血性坏死。
HDE:
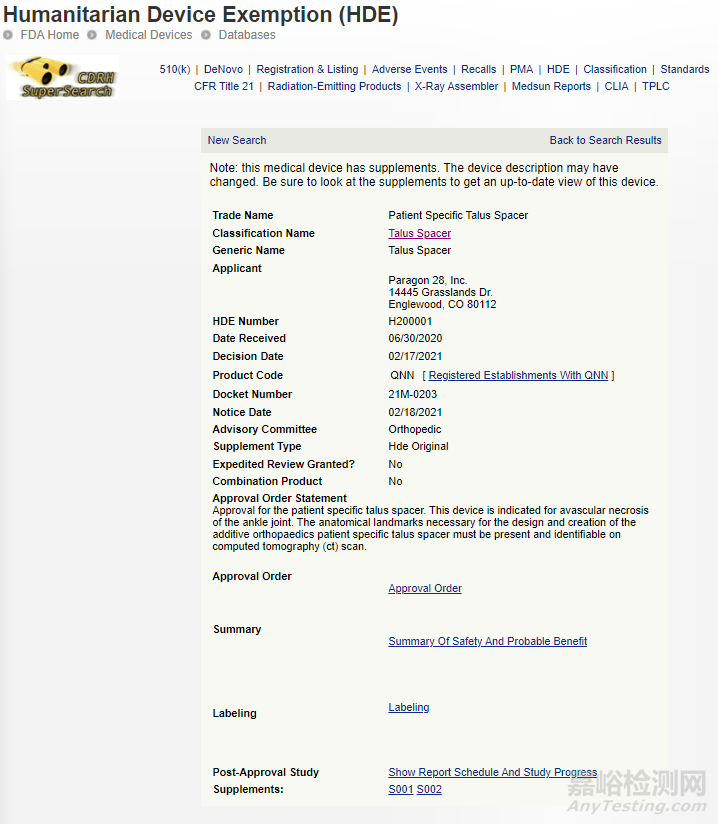
相关链接:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfhde/hde.cfm?id=H200001
5、VIVISTIM系统
用于在中风患者康复治疗期间模拟迷走神经。
SSED:

相关链接:
https://www.accessdata.fda.gov/cdrh_docs/pdf21/P210007B.pdf
6、COGNOA ASD 诊断辅助工具
一种基于机器学习的软件,旨在帮助医疗保健提供者诊断有潜在症状的18个月至5岁儿童自闭症谱系障碍。
De Novo:
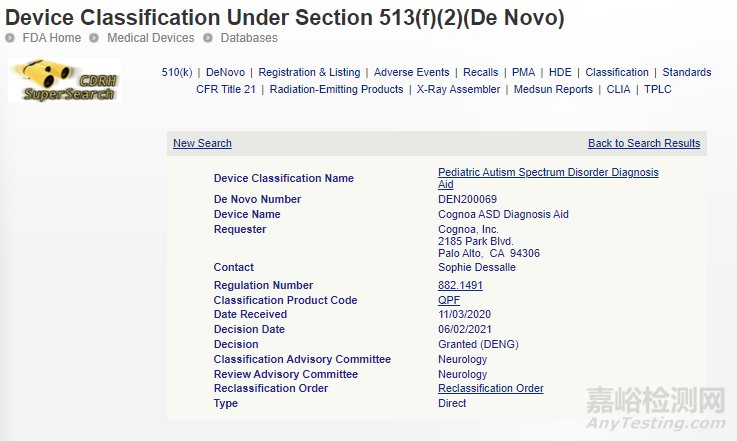
相关链接:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpmn/denovo.cfm?id=DEN200069
7、EASEVRX处方用沉浸式虚拟现实系统
使用认知行为疗法和其他行为方法来帮助 18 岁及以上被诊断为慢性腰痛的患者减轻疼痛。
De Novo:
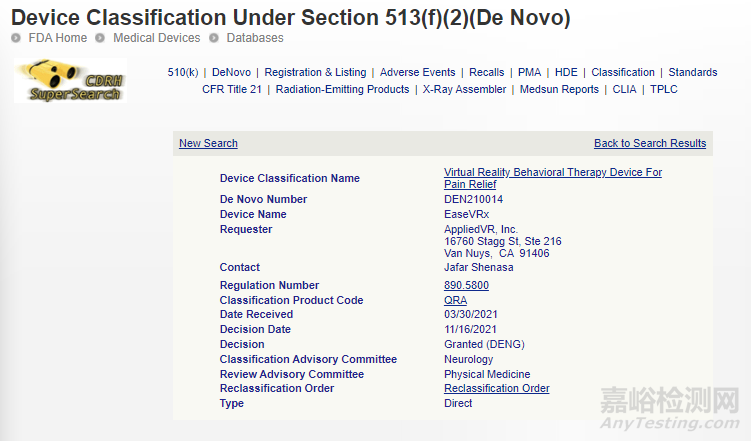
相关链接:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpmn/denovo.cfm?id=DEN210014
8、Harmony经导管肺动脉瓣膜系统
世界上第一个非外科手术心脏瓣膜,治疗患有天然或手术修复的右心室流出道的儿童和成人患者的严重肺动脉瓣关闭不全。
PMA:
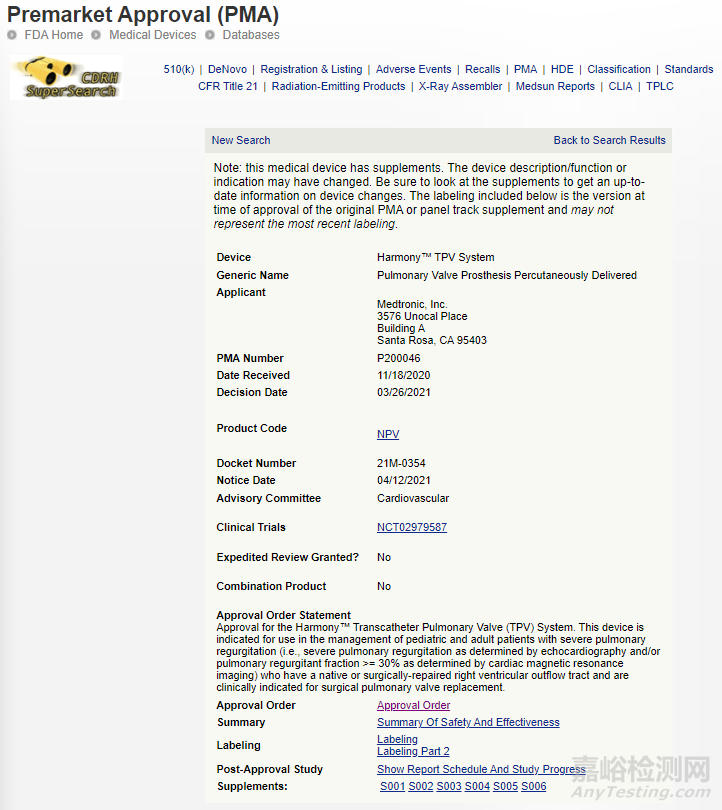
相关链接:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P200046
9、便携式神经调节刺激器 (PONS)
用于多发性硬化症 (MS) 引起的步态障碍的短期治疗。
De Novo:
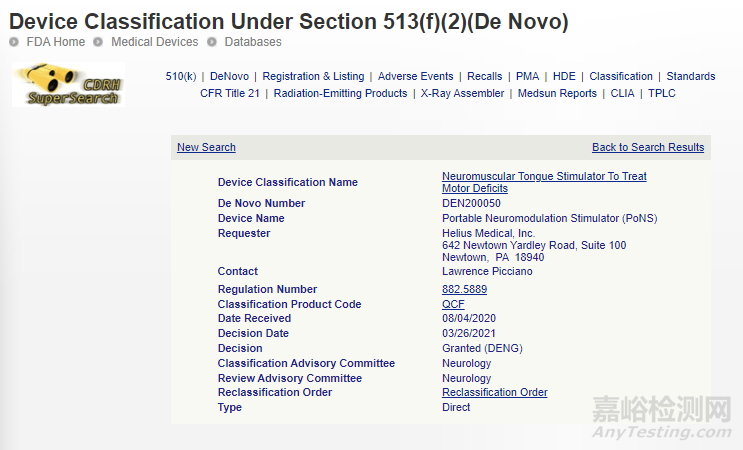
相关链接:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpmn/denovo.cfm?id=DEN200050
突破性指定
保护和提升公共卫生的一个关键方面是促进新型医疗器械上市。突破性器械计划为制造商提供了通过多种与 CDRH 专家互动的机会,以有效解决设备开发、评估和上市前审查期间出现的问题,以便制造商能够及时收到反馈并优先提交审查。自 2018 年以来,突破性器械计划显著地扩大,远超出了突破性指定请求和授权量的预期。2021 年,CDRH给与了213个器械突破性指定(自 2015 年项目启动以来共有 617 个突破性指定)。
截止2021年已获得批准的突破性疗法(部分):
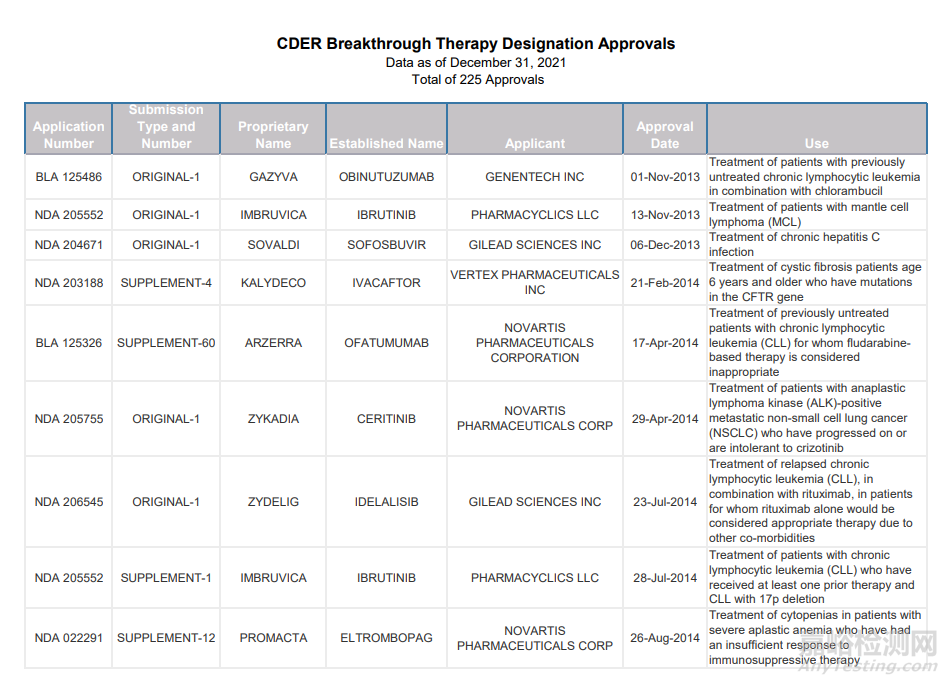
相关链接:
https://www.fda.gov/media/95302/download
突破性医疗器械
2021年,CDRH授权、批准了13个具有突破性指定的器械。
1、CDRH 批准了世界上第一个非外科手术心脏瓣膜,用于治疗患有原生或手术修复的右心室流出道 (RVOT) 的儿童和成人,RVOT指的是心脏将血液从右心室输送到肺部的区域。该设备专为患有严重肺动脉瓣关闭不全(血液向后漏入心脏右下腔)的患者设计,这种情况通常由先天性心脏病引起。该设备名为 Harmony 经导管肺动脉瓣 (TPV) 系统,旨在改善严重肺动脉瓣关闭不全患者的肺部血流,无需按目前的护理标准进行心脏直视手术。
相关链接:
https://www.fda.gov/news-events/press-announcements/fda-approves-first-world-device-treat-patients-congenital-heart-disease
2、CDRH 还授权上市了一种新设备,该设备适用于接受中风康复治疗的 18 岁及以上患者,以促进肌肉再训练和保持或增加运动范围。Neurolutions IpsiHand上肢康复系统(IpsiHand 系统)是一种脑机接口 (BCI) 设备,可帮助患有上肢或手、腕和手臂残疾的中风患者进行康复。中风后康复可以帮助个人克服中风损伤导致的残疾。IpsiHand 系统使用非侵入性脑电图 (EEG) 电极,而不是使用植入电极或其他侵入性器械来记录大脑活动。

相关链接:
https://www.accessdata.fda.gov/cdrh_docs/pdf20/DEN200046.pdf
在医疗器械安全行动计划下(Medical Device Safety Action Plan), CDRH于2021年建立了 STeP 计划,发布了最终指南并为首批设备授予STeP称号。
数字转型
目前,CDRH有30多个数据系统用于医疗器械的审查和监测。但是,它们过时、复杂、分散且耗时过长。CDRH的数字化转型计划旨在创建新系统,以改善CDRH内部和外部用户的体验;提高CDRH接收、存储、分析和分发数据的能力;并将CDRH的项目和运营数字化。
2021年6月,CDRH启动了决策管理门户 (DMP),这是一个新的内部平台,CDRH员工可以通过一个界面查看他们的所有工作;11月,CDRH启动了医疗器械报告 (MDR) 审查产品,这是DMP中的第一个工作流程,它将审查MDR的方式从高度定制的遗留系统转变为新型数字转换平台,改进了业务流程并提高了MDR审查的能力。510(k) 和 De Novo 审查的提交备忘录和审查模板 (SMART) 代表了CDRH最大的变化之一。SMART是审查者用来评估跨学科信息的自动化指南,提高了上市前审查过程的效率和一致性。2021年9月,CDRH还发布了指南草案“医疗器械 510(k) 提交的电子提交模板”,并启动了自愿电子提交模板 (eSTAR) 试点计划。自愿性 510(k) eSTAR 是一种交互式 PDF 表格,它严格遵循 SMART 模板中规定的 510(k) 审查的顺序和内容,同时使格式标准化并提高提交的质量。CDRH还增加了在 eSTAR 中准备De Novo请求的功能。自愿的eSTAR De Novo请求可以在 2022 年1月3日或之后提交给 FDA。
医疗器械 510(k) 提交的电子提交模板

相关链接:
https://www.fda.gov/media/152429/download
自愿电子提交模板 (eSTAR) 试点计划

相关链接:
https://www.fda.gov/medical-devices/how-study-and-market-your-device/voluntary-estar-program
数字医疗
从移动医疗应用程序和软件到人工智能(AI)和机器学习(ML),数字健康技术在提高我们准确诊断和治疗疾病的能力以及增强个人医疗保健服务方面具有巨大潜力。CDRH建立了数字健康卓越中心 (DHCoE),旨在通过促进高质量的数字健康创新,使患者、医疗保健从业者、研究人员和医疗器械公司能够更好地推进医疗保健。DHCoE在实现这一目标方面取得了很大进展,特别是在软件作为医疗器械 (SaMD)方面。
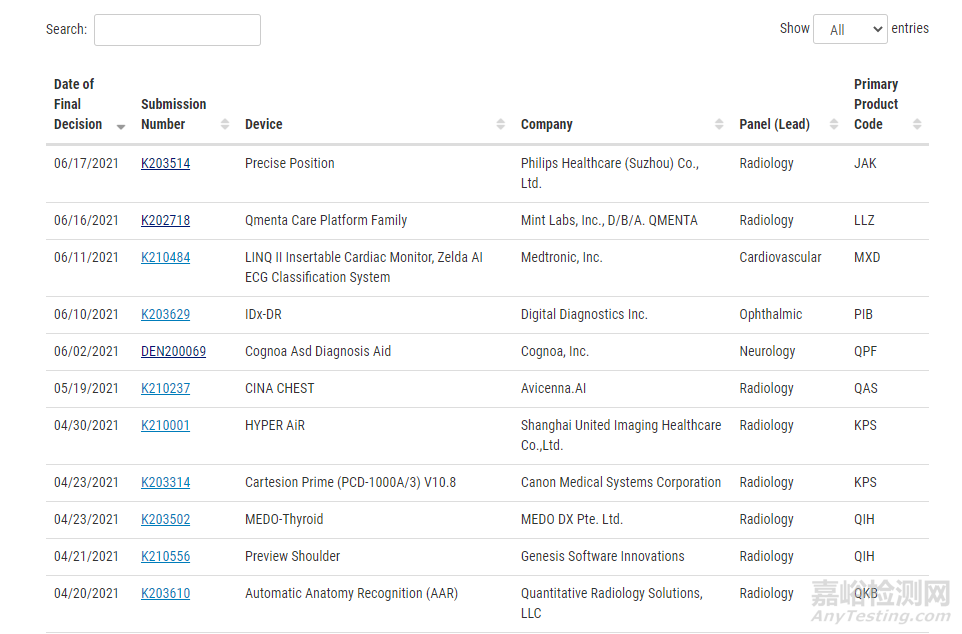
越来越多的医疗器械包含AI软件,自1997年以来,CDRH 已经审查并授权了300多个AI/ML 器械,涉及多个不同领域,其中仅 2021 年就授权了50余个。大多数依赖 AI/ML 的器械都属于SaMD类别,或属于旨在执行一个或多个医疗目的的软件类别。2020年,我们启动了软件预认证 (Pre-Cert) 试点计划,以帮助在美国为SaMD开发更精简、更高效的监管模式。
已在美国上市的支持AI/ML的医疗器械:
相关链接:
https://www.fda.gov/medical-devices/software-medical-device-samd/artificial-intelligence-and-machine-learning-aiml-enabled-medical-devices
2021年1月,CDRH发布了基于AI/ML的SaMD行动计划,该计划描述了一种多管齐下的方法来推进 FDA对基于AI/ML的医疗软件的监管。为了履行行动计划的一部分,CDRH在10月举办了一场关于支持AI/ML的医疗器械透明度公开研讨会。此外,在9月CDRH 推出了在美国合法销售的支持人工智能和机器学习 (AI/ML) 的器械列表。由DHCoE制定此列表以提高透明度和获取基于 AI/ML 的医疗器械的信息。10月,CDRH、加拿大卫生部和英国药品和保健品监管机构 (MHRA) 联合发布了《医疗器械开发中机器学习质量管理规范》(GMLP):促进使用AL/ML的医疗器械的安全性、有效性 。
基于AI/ML的 SaMD 行动计划

相关链接:
https://www.fda.gov/media/145022/download
支持AI/ML的医疗器械透明度的公开研讨会会议纪要

会议纪要链接:
https://www.fda.gov/media/154423/download
2021年12月,该机构发布了一份跨中心指南草案,“用于临床调查中远程数据采集的数字健康技术指南”,为申办方、研究人员和其他利益相关者提供有关使用数字健康的建议 (DHT) ,用于从评价医疗产品的临床研究参与者那远程获取数据。
用于临床调查中远程数据采集的数字健康技术指南

相关链接:
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/digital-health-technologies-remote-data-acquisition-clinical-investigations
非处方助听器规则
2021年10月,CDRH 提出了一项具有里程碑意义的规则,以确定一种新的非处方 (OTC) 助听器类别,来实施2017年FDA重新授权法案中颁布的《非处方助听器法案》中关键条款。该规则将允许某些助听器直接在商店或网上出售,无需进行体检或听力学家的验配。该规则旨在通过降低助听器制造商的准入门槛来促进创新,同时确保非处方和处方助听器的安全性和有效性。
非处方助听器规则

相关链接:
https://www.fda.gov/news-events/press-announcements/fda-issues-landmark-proposal-improve-access-hearing-aid-technology-millions-americans
监管科学工具
医疗器械开发工具(MDDT)计划是医疗器械申办方可以选择用于器械开发和评估的工具。这些工具包括生物标志物测试、临床结果评估和非临床评估模型,如动物或计算模型。所有这些工具都可以帮助CDRH了解医疗器械如何满足安全性、有效性和其他性能标准。这些工具还提高了行业的可预测性,使医疗器械申办方能够在批准的条件下使用合格的工具,而无需重新确认它们的适用性和实用性。
除了MDDT的资格外,CDRH 还继续整理监管科学工具目录。监管科学工具目录为公司提供了同行评审资源,可在相关标准和MDDT尚不存在的情况下使用。这些工具减少了器械开发人员设计临时测试方法,并允许他们将有限的资源集中在新产品的工作上,而不是如何测试它。为了进一步加快患者获得创新、安全和有效的医疗器械,CDRH 的科学与工程实验室办公室 (OSEL) 与 NIH/NCI 合作开发新工具,建立更广泛的工具创新网络,并考虑某些MDDT的第三方审查。
医疗器械开发工具(MDDT)计划

相关链接:
https://www.fda.gov/medical-devices/science-and-research-medical-devices/medical-device-development-tools-mddt

来源:致众医疗器械资讯


