您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-02-26 03:59
工艺用水是医疗器械产品实现过程中使用或接触的水的总称,主要适用于无菌医疗器械、植入性医疗器械以及体外诊断试剂产品生产过程中的产品清洗、配制、洁净服及工位器具清洗、环境清洗等环节,还可作为检测试剂制备的底液等。因其领域广、专业性强、用途多等特征,工艺用水成为目前医疗器械监管工作中的难点之一。
使用未经处理的工艺用水,会对医疗器械造成化学、微生物污染,影响产品安全性、试验准确性。《医疗器械工艺用水质量管理指南》(国家食品药品监督管理总2016年第14号通告)中提出,医疗器械生产企业应当按照《医疗器械生产质量管理规范》(国家食品药品监督管理总局2014年第64号公告)的要求,加强对工艺用水质量的管理,确保工艺用水的制备和使用不对医疗器械产品质量造成影响。
那么,不同种类的工艺用水中之间有何区别,以及质量标准有哪些呢?本文即将为您解答。
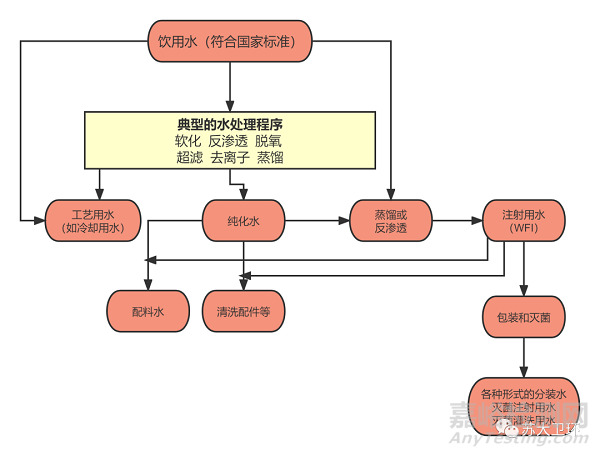
01、工艺用水都包括哪些水?各有哪些用途?
医疗器械工艺用水以饮用水为源水,主要包括以下几种:
纯化水:经蒸馏法、离子交换法、反渗透法或其他适应的方法制得的制药用水,不含任何添加剂,主要用于零部件、洁净区(室)工位器具和工作台面、洁净工作服、部分内包装容器等的清洗,以及作为生产工艺用冷却水、消毒液配制、工艺配料用水等。
体外诊断试剂用纯化水:主要用于体外诊断试剂生产、实验室试剂配制、仪器及器械清洗等。
注射用水:是指纯化水经蒸馏法或超滤法制备的同等要求的水,主要用于与药液直接接触的零配件的末道清洗、产品配料用水、储水器清洗、部分内包装容器清洗、无菌工作服清洗等。
灭菌注射用水:主要用于配料用水。
透析用水:主要用于透析液的制备、透析器的再处理、透析浓缩液的制备和在线置换液的制备。
分析实验室用水:主要用于实验室一般试剂配制、仪器及器械清洗等。
02、工艺用水主要有哪些质量标准?
《中华人民共和国药典》(2020年版)(以下简称“《中国药典》”)、《分析实验室用水规格和试验方法》(GB/T6682—2008),以及《体外诊断试剂用纯化水》(YY/T1244—2014)是当前医疗行业工艺用水质量标准的主要参考依据,也是监管人员在医疗器械GMP检查过程中对于工艺用水水质指标的主要参考依据。
03、工艺用水系统常见不符合项的判定依据?
《医疗器械生产质量管理规范》附录无菌医疗器械
《医疗器械生产质量管理规范》附录体外诊断试剂
《医疗器械工艺用水质量管理指南》
《医疗器械工艺用水检查要点指南(2014 版)》
《医疗器械工艺用水系统确认检查要点指南(2014 版)》
《体外诊断试剂现场检查指导原则》
《医疗器械生产质量管理规范无菌医疗器械现场检查指导原则》
04、工艺用水系统常见不符合项及其共性缺陷
|
不符合项 |
共性缺陷 |
|
|
|
|
|
|
|
|
/试剂 |
|
|
|
|
|
|
|
|
|
|
|

来源:苏大卫环


