您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-28 10:35
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
信立泰抗AD激越复方获批临床。信立泰自主研发的复方新药SAL0114片获国家药监局临床试验默示许可,拟用于阿尔兹海默激越的治疗。这是SAL0114获批临床的第2项适应症,该药上周刚刚在重度抑郁症上获批临床。目前全球尚未有批准的药物适应症为阿尔兹海默症激越。SAL0114片若能研发成功并获批上市,将进一步满足潜在的临床需求,为患者提供新的用药选择。
国内药讯
1.艾伯维JAK抑制剂在华获批上市。艾伯维口服JAK1抑制剂Rinvoq(瑞福®,乌帕替尼缓释片)获NMPA批准上市,用于治疗≥12岁、难治性中重度特应性皮炎(AD)患者。在一项国际Ⅲ期注册研究中,Rinvoq单药,以及与外用糖皮质激素联合治疗,在治疗16周后均达到主要和次要研究终点,达到皮损清除(EASI 90和EASI 100)的患者比例显著更高。这是Rinvoq在中国获批的首个适应症。在美国,Rinvoq已获批类风湿性关节炎、银屑病关节炎和AD等3个适应症。
2.亿帆医药长效升白药国内报产。亿帆医药旗下亿一生物开发的长效升白药「艾贝格司亭 α 注射液」(拟用商品名:亿立舒,F-627)的上市申请获CDE受理。F-627是一款重组人粒细胞集落刺激因子-Fc 融合蛋白,拟开发用于预防及治疗肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症。亿帆医药正在全球同步临床开发这款创新药,FDA和EMA已受理F-627递交的上市申请。在中国,正大天晴拥有F-627的独家商业化权益。
3.国药针对奥密克戎开发4款疫苗。国药集团中国生物副总裁、首席科学家张云涛日前在新闻会议上透露,针对目前全世界高度关注的奥密克戎变异株,国药集团在灭活、mRNA、基因重组3条技术路线上系统开发了4款疫苗。其中,国药集团中国生物开发了两款灭活疫苗用于奥密克戎变异株,目前已完成临床前的所有工作,正在滚动申报。
4.泰诺麦博1类新药拟纳入突破性治疗品种。泰诺麦博治疗用生物制品1类新药TNM002注射液获CDE拟纳入突破性治疗品种,用于预防破伤风。TNM002是一款抗破伤风毒素全人源单抗,正在澳大利亚和中国开展临床试验。澳大利亚人体试验数据显示,在一定剂量下给药12小时及超过100天后的“末次访视”时,血药浓度均超过“破伤风保护效价”;TNM002的安全性和耐受性良好,未发现明显与TNM002相关的不良事件。
5.圣诺siRNA疗法Ⅱ期临床积极。圣诺医药TGF-ß1/COX-2双靶点的小干扰RNA(siRNA)疗法STP705治疗皮肤基底细胞癌的Ⅱ期临床中期数据积极。与目前可用的局部疗法相比,STP705治疗组原位BCC病灶内的肿瘤细胞组织学完全清除的患者比例显著更高;试验中无药物相关的不良事件或严重不良事件。STP705已获得FDA和NMPA的多个IND批准,包括治疗胆管癌、非黑色素瘤皮肤癌和增生性瘢痕。
6.先声QPCT抑制剂获批AD临床。先声药业与Vivoryon公司联合开发的口服小分子谷氨酰肽环转移酶(QPCT)抑制剂PQ912获国家药监局临床试验默示许可,拟开发用于阿尔茨海默病(AD)导致的轻度认知障碍或轻度痴呆的治疗。PQ912通过抑制QPCT以阻止具有神经毒性的分子N3pE淀粉样蛋白生成,在疾病发病机制的早期发挥作用。此前,FDA已授予该药用于治疗早期AD的快速通道资格。
国际药讯
1.恩格列净获FDA扩展心衰分型。FDA批准勃林格殷格翰与礼来开发的SGLT2抑制剂Jardiance(恩格列净)新适应症,用于减少成人心衰患者的心血管死亡以及住院风险。在一项国际临床中,与安慰剂相比,Jardiance治疗组2年期因心血管死亡或因心衰住院的患者比例显著更少(14%vs17%)。此前,FDA已批准Jardiance用于辅助治疗2型糖尿病,用于减少罹患2型糖尿病且有心血管疾病的成人患者的心血管死亡风险,以及用于治疗射血分数降低型心力衰竭(HFrEF)。
2.欧盟CHMP推荐批准辉瑞偏头痛新药。欧洲药品管理局人用医药产品委员会(CHMP)推荐批准Biohaven公司与辉瑞联合开发的CGRP受体拮抗剂rimegepant(75mg,口服崩解片)上市,用于急性治疗偏头痛(有或无先兆),以及用于预防性治疗成人发作性偏头痛。如果获批,rimegepant将成为欧盟首个可同时用于偏头痛急性治疗和预防性治疗的口服CGRP受体拮抗剂。在欧盟,rimegepant将以品牌名Vydura上市销售。
3.FDA限制GSK/Vir新冠抗体使用范围。FDA已对葛兰素史克与Vir公司开发的新冠中和抗体sotrovimab的紧急使用授权进行了限制,该药物目前不可应用于病毒突变株对抗体不敏感的地区。在omicron突变株首次出现时,sotrovimab是少数被证明对其有效的抗体疗法之一。但最近的一项研究表明,omicron的ba2亚型几乎对所有抗体都有耐药性。FDA将根据变异易感性信息监测,以确定在特定地区内使用sotrovimab是否符合该授权范围。
4.BI新型PDE4B抑制剂获突破性疗法认定。勃林格殷格翰口服PDE4B抑制剂BI 1015550获FDA授予突破性疗法认定,用于治疗特发性肺纤维化(IPF)。在一项Ⅱ期临床中,BI 1015550单药,或与背景抗纤维化治疗联用,显著改善患者治疗12周时的肺活量(FVC)较基线的变化,具体结果将在ATS2022大会上公布。勃林格殷格翰计划在今年晚些时候启动Ⅲ期临床。
5.精准靶向疗法公司再获亿美元融资。精准免疫学公司Scipher Medicine宣布完成1.1亿美元融资,融资已累计达到2.27亿美元。Scipher专有的网络医学平台Spectra建立在十多年的实验研究基础上,能够分析人类基因组表达的蛋白质如何相互作用而形成特定疾病表型的网络图。Scipher旨在通过商业化血液检测,揭示每个患者独特的分子疾病特征,为每一例自身免疫性疾病患者匹配对应的最佳靶向治疗。
6.默沙东与Moderna终止mRNA癌症疫苗合作。Moderna公司在2021年财报中透露,已从默沙东重新获得靶向KRAS的癌症疫苗mRNA-5671所有权益。mRNA-5671是一种由脂质纳米粒递送的mRNA疫苗,编码KRAS的G12D、G12V、G13D、G12C四种突变抗原。目前,该项目已推进到I期临床阶段,开发治疗非小细胞肺癌、结直肠癌、胰腺癌。不过默沙东与Moderna还在合作开发另一款个性化癌症疫苗mRNA-4157。这款疫苗可以编码多达34种肿瘤新抗原。
医药热点
1.北京协和医院罕见病确诊时间平均4周。北京协和医院院长、全国罕见病诊疗协作网办公室副主任张抒扬26日在全国罕见病诊疗协作网工作会议上介绍,全国罕见病诊疗协作网转诊患者超过千例。与以往罕见病患者平均确诊时间4年相比,通过全国罕见病诊疗协作网转诊患者、采取罕见病“一站式救治方案”,在全国罕见病诊疗协作网国家级牵头医院北京协和医院,患者平均确诊时间不到4周。
2.海南发布免费接种HPV疫苗方案。2月23日,海南省卫健委发布为全省适龄女生(第1剂次接种年龄13周岁~14周岁半)免费接种人乳头瘤病毒(HPV)疫苗的实施方案。2022年拟接种7.1万人。疫苗接种采取统一组织、预约登记、集中接种的方式。以学校为单位组织适龄女生接种。不在校的适龄接种对象,由其所在地街道、乡镇政府组织摸底和预约通知。
3.奥密克戎二次感染者为年轻人。丹麦国立血清研究所新近发布的研究报告显示,奥密克戎变异新冠病毒原始毒株BA.1感染者,在痊愈后仍可能感染奥密克戎进化分支BA.2,但这种情况仍然比较少见。2021年11月22日至2022年2月11日期间,丹麦在180万例新冠患者监测中发现两次感染奥密克戎变异(BA.1和BA.2)新冠病例47例。这些奥密克戎二次感染者主要是未接种新冠疫苗的年轻人。
评审动态
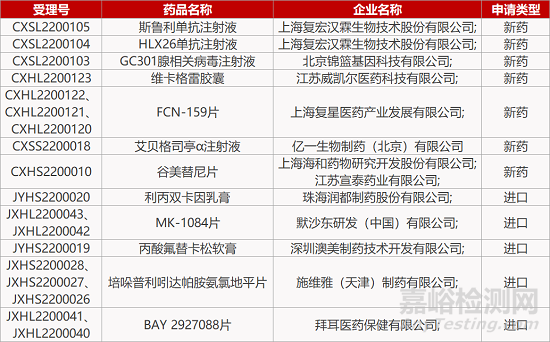
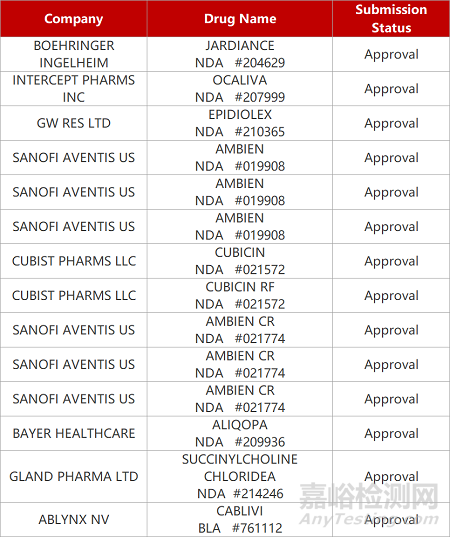

来源:药研发


