您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-09 11:34
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
信达双靶点降糖药减重临床成功。信达生物与礼来联合开发的GLP-1R/GCGR双重激动剂mazdutide(IBI362),在用于治疗中国超重或肥胖患者的Ⅱ期临床达到主要研究终点和所有的关键次要终点。与安慰剂相比,mazdutide(3.0mg、4.5mg和6.0mg)治疗组患者24周后体重显著减少,降幅最大达到12.6%。体重相对基线百分比变化的最小二乘均值分别为−7.21%(−6.35kg)、−10.56%(−9.07kg)和−11.57%(−9.85kg),安慰剂组为1.05%(1.08kg);体重相对基线百分比变化的差异的最小二乘均值分别为−8.26% ,−11.60%和−12.62%。此外,该新药总体耐受性良好。
国内药讯
1.辉瑞JAK3/TEC抑制剂拟纳入突破性疗法。辉瑞口服特异性JAK3/TEC抑制剂ritlecitinib胶囊(PF-06651600)获CDE拟纳入突破性治疗品种,针对适应症为重度活动性溃疡性结肠炎。值得一提的是,此前该疗法已被CDE纳入突破性治疗品种,用于治疗≥12岁中重度斑秃患者。Ritlecitinib目前正被辉瑞开发用于治疗斑秃、克罗恩病、类风湿关节炎、溃疡性结肠炎或白癜风患者,其中斑秃适应症的开发在美国已进入Ⅲ期阶段。
2.康诺亚IL-4Rα单抗拟纳入突破性疗法。康诺亚生物1类生物制品CM310重组人源化单克隆抗体注射液获CDE拟纳入突破性治疗品种,针对适应症为中重度特应性皮炎。CM310已在治疗特应性皮炎的Ⅱb期临床中达到主要终点,与安慰剂相比,CM310(300mgQ2W和150mgQ2W)治疗组16周时达到EASI-75的患者比例更高(73.1%和70.6%,vs18.2%)。去年3月,康诺亚已把CM310的哮喘适应症国内权益授予石药集团旗下津曼特生物。
3.徐诺HDAC抑制剂Ⅱ期临床积极。徐诺药业在ASCO2022年会上公布口服泛HDAC抑制剂艾贝司他单药三线治疗复发难治滤泡性淋巴瘤(XYN-605)的中国Ⅱ期临床的中期数据。在37例可评估患者中,艾贝司他达到70%的客观缓解率(ORR),完全缓解率(CR)为19%,疾病控制率(DCR)为93%。在≥60岁的16例患者中,ORR为88%,CR为31%,DCR为100%。该新药的安全性特征与已知研究一致。
4.上海研健SGLT抑制剂II期临床积极。上海研健开发的SGLT1/SGLT2双重抑制剂YG1699,在用于治疗I型糖尿病的美国II期临床达到主要终点。该项试验旨在比较YG1699与SGLT2单抑制剂达格列净相比用于I型糖尿病患者的疗效,主要评估在混合膳食耐受试验期间的餐后血糖控制。结果显示,YG1699能更为有效地控制患者的餐后血糖。详细数据将于今年9月的欧洲糖尿病大会(EASD)会议上公布。
5.加科思KRAS抑制剂早期临床积极。加科思药业在ASCO2022年会上首次公布KRAS G12C抑制剂JAB-21822治疗非小细胞肺癌的Ⅰ期临床积极数据。在32例可评估患者中,JAB-21822的客观缓解率(ORR)为56.3%(18/32),疾病控制率(DCR)为90.6%(29/32)。在每日400mg及每日800mg的剂量组中,ORR为66.7%(8/12),DCR为100%(12/12)。此外,JAB-21822耐受性良好,在剂量递增阶段无剂量限制性毒性(DLT)。
国际药讯
1.度普利尤单抗获批用于婴幼儿湿疹。再生元与赛诺菲联合开发的IL-4/IL-13抑制剂度普利尤单抗(Dupixent)获FDA批准扩展适应症,用于治疗6个月到5岁的中重度特应性皮炎儿科患者。在一项Ⅲ期临床中,与外用皮质类固醇(TCS)相比,Dupixent联合TCS使患儿的皮肤症状完全或接近完全清除的比例达到28%(vs4%);而且安全性特征与在6岁以上特应性皮炎儿童中观察到的结果相似。
2.Novavax新冠疫苗将获FDA批准上市。FDA疫苗和相关生物制品咨询委员会推荐批准Novavax公司研发的新冠疫苗NVX-CoV2373上市。一项III期临床数据显示,该疫苗的总体疗效为90.4%,其中针对65岁及以上人群的保护力达到78.6%。但由于该研究是在Delta和Omicron变种出现之前进行的,因此该疫苗没有针对Omicron毒株的保护力数据。Novavax于5月31日启动的针对Omicron毒株的疫苗的III期试验,预计将在2022年下半年取得初步的结果。
3.糖尿病细胞袋移植疗法长期疗效积极。Sernova公司细胞袋移植疗法,在治疗此前依赖胰岛素治疗的1型糖尿病患者的Ⅰ/Ⅱ期临床最新结果积极。3例患者接受细胞袋包装的胰岛组织移植后,总体耐受性良好;并全部达到完全脱离胰岛素治疗的目标,其中1例患者维持胰岛素独立性超过2年;所有患者同时表现出积极的血清C肽水平,糖化血红蛋白均处于正常范围内。详细结果公布在美国糖尿病协会科学会议上。
4.诺华靶向组合疗法儿童脑瘤临床积极。诺华在ASCO年会上公布BRAF抑制剂Tafinlar联合MEK抑制剂Mekinist,用于治疗BRAF V600变异、儿科低级别胶质瘤的Ⅱ/Ⅲ期临床积极结果。与标准化疗相比,这一组合显著提高患者的总缓解率(47%vs11%,p<0.001);中位随访为18.9个月时,中位PFS达到20.1个月(vs7.4个月,HR=0.31,p<0.001)。如果获批,该组合有望为这些儿科脑瘤患者提供新标准治疗。
5.恩格列净真实世界分析结果积极。礼来与勃林格殷格翰开发的SGLT2抑制剂Jardiance(恩格列净),在美国糖尿病协会科学会议上,公布美国真实世界研究EMPRISE的两项分析数据。该研究评估糖尿病药物Jardiance在日常临床照护中与DPP-4抑制剂或GLP-1受体激动剂相比的疗效与安全性。研究结果显示,Jardiance与DPP-4抑制剂和GLP-1受体激动剂相比,可分别将因心衰导致住院的风险相对降低50%与30%;与DPP-4抑制剂相比,Jardiance与因心力衰竭或中风产生的综合性结果相关风险降低12%。
6.BMS撤回贫血疗法sBLA申请。百时美施贵宝宣布在美国撤回血红细胞成熟剂Rebrozyl用于非输血依赖性(NTD)β地中海贫血的补充生物制品许可申请(sBLA)。今年3月,该项sBLA的PDUFA日期被FDA延长至6月27日。百时美施贵宝目前已停止Rebrozyl用于这一适应症开发的II期临床BEYOND。该公司认为BEYOND试验收集到的数据无法向FDA阐明在该患者群体中Rebrozyl的收益风险状况。
医药热点
1.清华大学拟成立医学部。6月6日,清华大学发布消息称,为服务健康中国战略,完善一流大学布局,立足清华新百年学科建设与发展目标,清华大学拟建立医学部(本部),并将于6月10日(周五)举办仪式,以统筹规划清华大学医学事业的进一步发展。至此,清华大学的医学体系中,已经拥有了清华大学医学院;医学院下设的临床医学院;清华大学医学部;清华大学医学部(本部)。
2.严查医务人员利用职务之便直播带货。国家卫健委、公安部、国家市场监管总局等9部门联合印发通知,纠正医药购销领域和医疗服务中的不正之风,着力解决群众反映强烈的突出问题。通知明确要求,要深入开展医疗领域乱象治理,维护医保基金安全,惩治“红包”、回扣等行风问题,严肃查处医疗机构工作人员利用职务、身份之便直播带货。
3.上海青少年近视率近30年首降。上海市卫健委最新发布的调查数据显示,2021年,上海儿童青少年总体近视率为60%,较2020年下降1.2个百分点,是近30年来的首次下降;50岁及以上人群盲、视力损伤率分别为0.41%、6.42%,白内障手术覆盖率为92.53%,眼镜覆盖率为60%,中老年人群防盲有关指标达到发达国家水平。
评审动态
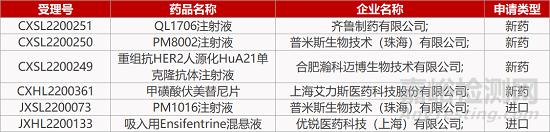
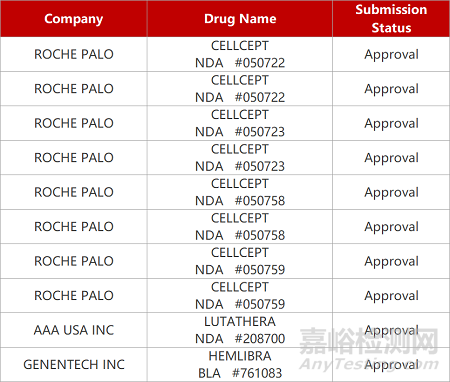

来源:药研发


