您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-16 11:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
联拓FIC放疗增敏剂启动Ⅲ期临床。Nanobiotix公司与联拓生物联合开发的潜在“first-in-class”的新型放射增敏剂NBTXR3,在国内登记启动一项国际Ⅲ期试验,评估研究者选择的单独放疗或联合西妥昔单抗的放疗激活瘤内注射NBTXR3在不适合接受含铂药物方案化疗的老年局部晚期头颈部鳞状细胞癌患者中的生存结局。主要研究者由山东省肿瘤医院医学博士于金明担任。NBTXR3由功能化二氧化铪(HfO2)纳米颗粒组成。
国内药讯
1.恒瑞TPO-R激动剂获孤儿药认定。恒瑞医药海曲泊帕乙醇胺片获FDA授予的孤儿药资格认定,用于治疗恶性肿瘤化疗所致血小板减少症。海曲泊帕乙醇胺是一种TPO-R激动剂,通过激活TPO-R介导的STAT和MAPK信号转导通路,促进血小板生成。该新药已在国内获批用于治疗对糖皮质激素、免疫球蛋白反应不佳的慢性原发免疫性血小板减少症,以及用于治疗对免疫抑制治疗疗效不佳的重型再生障碍性贫血。
2.阿斯利康B7-H4 ADC在华获批临床。阿斯利康治疗用生物制品1类新药AZD8205获国家药监局临床试验默示许可,拟用于治疗晚期或转移性实体恶性肿瘤。这是继翰森制药HS-20089后,国内第2家获批临床的B7-H4抗体偶联药物(ADC)。根据2022 AACR会议摘要,在一项TNBC PDX肿瘤模型研究中,3.5 mg/kg AZD8205单次IV给药的总缓解率为69%,完全缓解率为9/26(36%)。
3.盛世泰科两款1类新药获批临床。盛世泰科自主研发的两款1类创新药物CGT-1881和CGT-9475获国家药监局临床试验默示许可。CGT-1881是一款CXCR4拮抗剂,适用于非霍奇金淋巴瘤(NHL)或多发性骨髓瘤(MM)患者动员造血干细胞进入外周血,以便完成造血干细胞的采集与自体移植;CGT-9475是一款新一代ALK抑制剂,已在临床前研究中显示出对非小细胞肺癌细胞系中L1196M、RET等耐药突变具有显著抑制作用,有望用于耐药突变的后续治疗。
4.荣昌PD-L1抗体联合ADC获批临床。荣昌生物在研PD-L1抗体注射用RC98获国家药监局临床试验默示许可,拟联合抗体偶联药物(ADC)维迪西妥单抗用于实体瘤的治疗。这是一项开放性、剂量递增的Ⅰ期临床,旨在评价联合治疗在HER2表达局部晚期或转移性实体瘤受试者的安全性、耐受性、药代动力学特征和初步疗效。维迪西妥单抗是荣昌生物自主研发的ADC新药,也是中国首个获批上市的原创性ADC新药。
5.宝船CLDN18.2/CD47双抗报IND。CDE受理宝船生物自主研发的首个双特异性抗体BC007抗体注射液的临床试验申请。BC007抗体注射液可同时靶向CLDN18.2/CD47,体内药效学研究表明,BC007抗体注射液在胃癌、胰腺癌、肠癌等多种恶性肿瘤中均显示出优异的抗肿瘤效果。目前国内药企凡恩世生物也在布局CLDN18.2/CD47双抗,该公司同类产品PT886预计将在2022年第二季度向FDA提交IND申请。
国际药讯
1.蓝鸟又一款基因疗法获FDA专家支持。蓝鸟生物一次性基因疗法betibeglogene autotemcel(beti-cel)日前获FDA细胞、组织和基因疗法咨询委员会成员的全票支持,认为beti-cel用于输血依赖型β地中海贫血患者的获益大于风险。beti-cel已在多项临床中获得积极结果,接受beti-cel治疗的63例患者中,有2例患者的随访时间长达7年,8例患者的随访时间至少6年,19例患者随访时间超过5年。如果获批,这将是FDA批准的首款造血干细胞体外基因疗法。
2.FDA批准用于MS的外骨骼机器人。Ekso Bionics公司开发的外骨骼机器人设备EksoNR获FDA批准,这种人机一体化机械结构可帮助佩戴者从轮椅上站起来,用于多发性硬化(MS)患者的康复。EksoNR的设计通过加强患者臀部、膝盖和脚踝以帮助支撑自然的行走步态,旨在使患者延长住院治疗过程而不感到疲劳。此前,EksoNR已获FDA批准用于卒中和脊髓损伤、获得性脑损伤患者的康复。
3.礼来引进Kv1.3抑制剂全球开发权益。礼来宣布与D. E. Shaw Research (DESRES)公司就后者临床早期的高选择性离子通道蛋白Kv1.3口服小分子抑制剂DES-7114达成全球独家许可协议。DES-7114拟开发用于溃疡性结肠炎、克罗恩病和特应性皮炎等自身免疫性疾病的治疗。根据协议,礼来将获得DES-7114在全球的临床开发和商业化权利,并向DESRES支付6000万美元的首付款、4.75亿美元里程金和销售版税。
4.ImCheck拟加速BTN3A单抗开发。ImCheck公司完成9600万欧元融资,以支持其主打在研疗法ICT01开展治疗实体瘤和血液癌症的Ⅱa期临床试验,以及评估ICT01联合PD-1抑制剂治疗多种实体瘤的临床试验。ICT01是一款靶向嗜乳脂蛋白家族成员BTN3A的单克隆抗体,通过与BTN3A结合来选择性激活γ9δ2 T细胞,促进它们迁移和浸润肿瘤,进一步激发CD8阳性T细胞和自然杀伤细胞的抗肿瘤反应。
5.抗体药物公司Dren Bio完成B轮融。Dren Bio公司宣布完成6500万美元的B轮融资,以进一步推进其强化抗体依赖性细胞毒性项目和靶向膸系细胞衔接蛋白与吞噬作用平台的开发。Dren Bio的主打产品DR-01可连接血液癌症细胞与自然杀伤(NK)或CD8阳性T细胞,有效并快速引发抗体依赖性细胞毒性,进而引发癌细胞的溶解。此轮融资将主要用于初步检验DR-01在血液癌症和自体免疫疾病上的临床潜力。
6.辉瑞新冠口服药Paxlovid一项II/III期临床失败。辉瑞宣布新冠口服药Paxlovid针对未接种疫苗的新冠成年患者的II/III期临床(EPIC-SR)未达到主要终点指标。中期分析显示Paxlovid未能使患者的新冠症状持续缓解达到4天;关键次要终点的最新分析显示,住院或死亡相对风险降低51%(5/576vs10/569),不具有统计学意义;在至少有一个进展为重度新冠风险因素、并已接种疫苗的亚组中,患者住院或死亡的相对风险降低57%(3/361vs7/360)。
医药热点
1.日本将新设疾控中心。为应对新冠病毒及新型传染病危机,日本政府将在内阁官房下成立“内阁感染症危机管理厅”,以美国疾病控制与预防中心为范本,打造疾控中心。内阁感染症危机管理厅由首相直接管辖,可统一管理相关组织,强化应对疫情能力。日本政府还将整合国立感染症研究所与国立国际医疗研究中心的功能,充分调动专家学者资源应对新型传染病疫情。
2.广东率先免费接种HPV疫苗。广东省卫健委日前透露,广东省21个地级市、122个县(市、区)自2022年起统一开展适龄女生人乳头瘤病毒(HPV)疫苗免费接种项目。广东省将成为全国率先在全省范围内开展HPV疫苗免费接种的省份。目前,该省已完成所需疫苗统一招标工作,21个地市均已与中标供应商签订采购合同。疫苗免费接种项目预计每年受益人群超过75万。
3.浙江启用电子献血证新功能。浙江省日前上线启用电子无偿献血证新功能。新版电子无偿献血证增加了“志愿汇”公益权益领取、益币兑换和电子获奖证书查询等新功能,还为稀有血型献血者推出“熊猫侠”专属版本。据统计,2020—2021年,浙江省卫生健康人员参加无偿献血累计10.67万人次,献血总量达3011.5万毫升,人群千人献血率达86.7‰,为全省平均献血率的7.28倍。
评审动态
2. FDA新药获批情况(北美06月14日)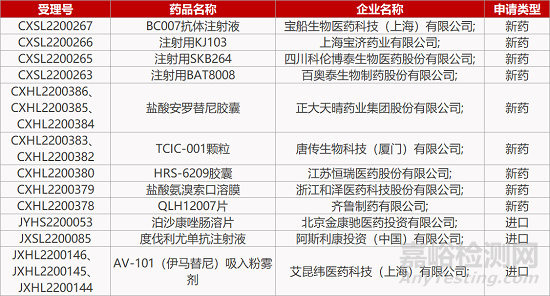
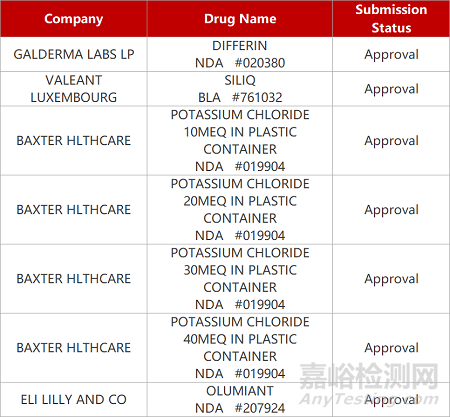

来源:药研发


