您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-30 11:23
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
康方PD-1/CTLA-4双抗获批上市。康方生物自主研发的PD-1/CTLA-4双特异性抗体卡度尼利单抗注射液(AK104)获国家药监局批准上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者。这是全球首款获批的基于PD-1的双抗药物,也是全球首款PD-1/CTLA-4双抗获批。在关键Ⅱ期临床中,AK104在可评估患者中达到33.0%确认的客观缓解率,完全缓解率为12.0%,6个月和12个月持续反应时间率分别为77.6%和52.9%。
国内药讯
1.恒瑞AR抑制剂获批上市。恒瑞医药第二代AR抑制剂SHR3680片(瑞维鲁胺)获国家药监局批准上市,用于治疗高瘤负荷的转移性激素敏感性前列腺癌(mHSPC)。在III期临床(CHART)中,与比卡鲁胺联合雄激素剥夺疗法(ADT)相比,SHR3680联合ADT降低患者发生影像学进展或死亡的风险54%;两组中位随访时间分别为30.5和27.5个月,24个月OS率分别为81.6%与70.3%。恒瑞也在推动SHR3680针对前列腺癌其它发展阶段的2期和3期研究。
2.拜耳「非奈利酮」获批中国上市。拜耳申报的非奈利酮(finerenone)获国家药监局批准上市,适用于与2型糖尿病相关的慢性肾脏病成人患者,可降低肾小球滤过率估计值(eGFR)持续下降、终末期肾病的风险。finerenone是一款“first-in-class”非甾体选择性MRA拮抗剂,已于去年7月获FDA批准用于治疗伴有慢性肾病(CKD)的2型糖尿病患者。在FIDELIO-DKD研究中,与标准治疗相比,finerenone使患者的肾病进展减缓18%,将心血管风险降低14%。
3.再鼎第四代EGFR抑制剂获批临床。再鼎医药从Blueprint Medicines公司引进的口服第四代EGFR抑制剂BLU-945胶囊获国家药监局临床试验默示许可,拟开发适应症为EGFR突变型非小细胞肺癌。在Ⅰ/Ⅱ期临床SYMPHONY中,BLU-945能够剂量依赖性降低循环肿瘤DNA;最高剂量BLU-945治疗的患者有1例获得部分缓解;而且BLU-945表现出良好的安全性。数据支持在EGFR突变的NSCLC患者中进行全面组合疗法的临床开发。
4.复宏汉霖合作开发两款抗肿瘤新药。复宏汉霖与Palleon公司将利用后者专有酶-抗体聚糖配体编辑(EAGLE)平台,针对复宏汉霖提供的肿瘤相关抗原(TAA)靶向抗体,合作开发和商业化双功能抗体-唾液酸酶融合蛋白,包括Palleon一款HER2抗体-唾液酸酶融合蛋白。根据协议,Palleon将获得首付款、1.965亿美元的里程碑付款和产品的销售分成。Palleon将主导这两款产品的早期研究,双方将共同负责临床前和全球临床开发并分担相应费用。复宏汉霖将拥有两款产品在中国(包括香港、澳门及台湾)的独家许可。
5.信达又一眼科双抗报IND。信达生物1类生物药IBI333的临床试验申请获CDE受理。IBI33是一款靶向VEGF-A/VEF-C的全人源融合蛋白双克隆抗体,在激光诱导的脉络膜新生血管(CNV)模型中,可抑制游离的VEGF-A/VEGF-C。信达计划今年下半年开展IBI333用于治疗脉络膜新生血管(CNV)患者的临床研究。这是信达针对眼科疾病开发的第三款基于VEGF的双抗药物。
国际药讯
1.吉利德长效HIV新药重报NDA。吉利德宣布已向FDA重新提交HIV衣壳抑制剂lenacapavir的上市申请,用于治疗既往接受过多次治疗、多重耐药的HIV-1感染者。今年3月,FDA曾因硼硅酸盐玻璃小瓶与lenacapavir注射液的相容性问题发送完整回应函(CRL),并暂停lenacapavir至少10项临床试验。在全面审查后,FDA解除lenacapavir的临床暂停。如果获批,lenacapavir将成为唯一一款每年只需给药2次的HIV治疗药物。
2.FIC狼疮肾炎药物Ⅱ期临床积极。Kezar Life公司潜在“first-in-class”免疫蛋白酶体抑制剂zetomipzomib(KZR-616)在治疗活跃狼疮性肾炎(LN)的Ⅱ期临床MISSION获积极结果。每周一次皮下注射zetomipzomib与基础疗法联合治疗24周后,有64%的患者获得肾脏缓解,有35.2%的患者获得肾脏完全缓解。药物在试验期间具有良好的耐受性。该公司计划继续针对LN患者进行zetomipzomib的开发,并同时评估该药用于治疗红斑狼疮的潜力。
3.武田RNAi疗法特定肝病Ⅱ期临床积极。武田与Arrowhead公司联合开发的RNAi疗法fazirsiran,在治疗α-1抗胰蛋白酶缺乏症(AATD)相关肝病的Ⅱ期临床获积极结果。fazirsiran旨在减少突变α-1抗胰蛋白酶的产生,并尽可能促进肝脏再生和修复。24周或48周治疗数据显示,fazirsiran使患者肝脏中突变AAT蛋白水平降低83.3%,并改善炎症状况。患者的突变蛋白平均负荷评分从7.4降低到2.3,降幅69%。研究成果发表在《新英格兰医学杂志》上。
4.AI药物公司MALT1疗法获FDA临床许可。FDA批准Schrödinger公司基于物理的计算平台开发的MALT1抑制剂SGR-1505的临床试验申请。该候选疗法是Schrödinger公司计算平台通过准确评估82亿个化合物,并在合成和测试前以及在迭代过程中,对化合物进行全面评估和优化选择最终筛选而来。该公司预计今年下半年启动SGR-1505在复发/难治性B细胞淋巴瘤患者中的Ⅰ期临床试验。
5.辉瑞联合Priovant开发自免治疗新药。辉瑞与Roivant Sciences联合宣布,两家公司去年9月合作创建的Priovant Therapeutics新公司将负责开发和销售brepocitinib和ropsacitinib两款TYK2抑制剂。Brepocitinib是辉瑞开发的一款潜在“first-in-class”TYK2/JAK1双分子抑制剂,Priovant拥有口服和外用brepocitinib的全球开发权以及美国和日本的商业权。Priovant目前正在开展brepocitinib用于治疗皮肌炎的Ⅲ期临床,并预计在明年下半年完成针对系统性红斑狼疮( SLE )的国际IIB期研究患者入组。
6.安斯泰来布局抗体偶联免疫激动剂。安斯泰来与Sutro Biopharma将利用后者专有的免疫激活性抗体偶联药物(iADCs)技术平台,针对3个不同的生物靶标合作开发创新iADCs候选药物。根据协议,Sutro将负责临床前研究和发现候选化合物,安斯泰来将负责临床期开发。Sutro将获得9000万美元的前期付款,并且针对每个候选药物,有资格获得4.225亿美元的开发、监管和商业化里程碑付款。
医药热点
1.诺华拟全球裁员约8000人。诺华日前对外透露,计划裁员多达8000人,约占公司员工总数的7%,其中包括在瑞士的多达1400个职位,希望到2024年至少节省10亿美元。诺华将引入新的组织结构和运营模式,整合制药和肿瘤业务部门为一个创新药物部门;合并策略、研发投资组合战略和商务拓展三个部门,创建一个新的战略与增长业务部;最后合并技术运营部门和客户及技术解决方案部门,创建一个新的运营部门。
2.落实疫情防控“九不准”留言板上线。国务院联防联控机制6月28日在京召开新闻发布会,国家卫健委监督局副局长程有全在会上表示,国家卫健委网站已于当天开通落实疫情防控“九不准”公众留言板,公众可通过这一渠道反映疫情防控层层加码的问题。针对公众反应的已核实的层层加码问题和典型案例,将通过国务院联防联控机制新闻发布会、部门网站或政务新媒体等方式督促整改,进行通报和曝光。
3.通信行程卡取消“星号”标记。据工信部网站6月29日消息,为坚决落实党中央、国务院关于“外防输入、内防反弹”总策略和“动态清零”总方针,支撑高效统筹疫情防控和经济社会发展,方便广大用户出行,即日起取消通信行程卡“星号”标记。
4.中国科技成果转化年度报告出炉。6月29日,《中国科技成果转化年度报告2021(高等院校与科研院所篇)》在京发布。《报告》显示,我国科技成果转化活动持续活跃,2020年,3554家高校院所以转让、许可、作价投资和技术开发、咨询、服务方式转化科技成果的合同项数以及合同金额均有增长,合同项数为466,882项,合同总金额为1,256.1亿元。其中,转化科技成果超过1亿元的高校院所数量为261家。
评审动态
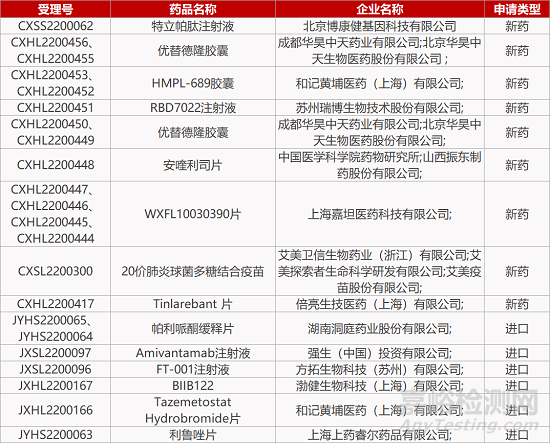
2. FDA新药获批情况(北美06月28日)
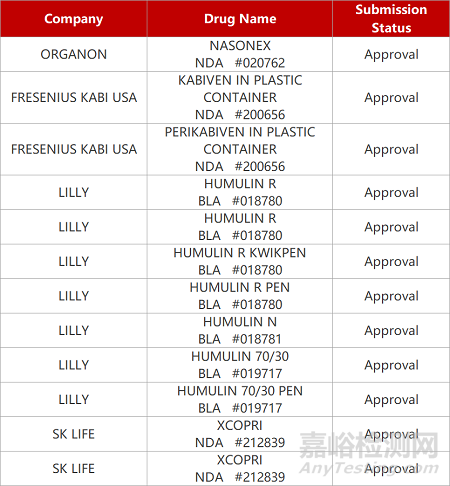

来源:药研发


