您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-04 11:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
三迭纪首款3D打印药物获批临床。南京三迭纪医药首个3D打印药物T19获国家药监局临床试验默示许可,这是一款按照2.2类改良型新药进行临床申报的枸橼酸托法替布延迟缓释口服片剂,可与甲氨蝶呤或其他非生物改善病情抗风湿药联用,适用于甲氨蝶呤疗效不足或不耐受的中重度活动性类风湿关节炎成年患者。在美国,T19已通过505(b)(2)路径进行注册申报,并于2021年获得FDA临床许可。
国内药讯
1.中生捷诺猴痘快检试剂盒获欧盟CE认证。国药集团中国生物旗下上海捷诺生物自主研发的猴痘病毒核酸检测试剂盒(荧光PCR法)日前获得欧盟CE认证。该试剂通过实时荧光PCR法检测猴痘病毒的特异性基因片段,可准确鉴别猴痘病毒,助力相关疾病的精准诊断与防控。据悉该试剂具有灵敏度高、特异性好的优势,可检出样本中低浓度病毒,并快速获得检测结果。
2.百泽安联合化疗食管癌Ⅲ期临床成功。百济神州与诺华联合开发的PD-1替雷利珠单抗(百泽安)与化疗联用,在一线治疗晚期或转移性食管鳞状细胞癌(ESCC)的国际Ⅲ期临床RATIONALE 306结果积极。与安慰剂联合化疗相比,替雷利珠单抗联合化疗使患者死亡风险降低34%,两组患者中位OS分别为17.2个月[95% CI:15.8~20.1]和10.6个月[95% CI:9.3~12.1]。无论患者PD-L1表达如何,均观察到联合治疗的OS获益。
3.箕星FIC心肌病新药获批Ⅲ期临床。箕星药业与Cytokinetics公司联合开发的新型口服小分子心肌肌球蛋白抑制剂aficamten(CK-3773274)获CDE批准开展Ⅲ期临床。该试验是全球多中心研究SEQUOIA-HCM的一部分,拟评估aficamten用于症状性梗阻性肥厚型心肌病(oHCM)的24周疗效。研究主要目的是通过从基线至第24周心肺运动试验(CPET)测定的最大摄氧量(pVO2)变化以评价aficamten对症状性oHCM患者运动能力的影响。预计将入组270例患者,其中包括约40例中国患者。
4.天津星魅溶脂针IIb期临床积极。天津星魅生物引进的小分子溶脂针JS-001(RZL-012)在一项针对下颌减脂的IIb期临床达到主要终点。单次注射后第84天,JS-001使患者的下颏脂肪量平均减少15%,不良反应主要局限在注射部位且多为一过性。此前,该新药针对腹部减脂的IIa期临床数据显示,JS-001单次注射后56天可减少注射部位脂肪量15~20%。据悉,JS-001将在2022年底启动一项包括中国大陆在内的国际III期临床。
5.复星凯特第2款CAR-T启动临床。复星凯特从Kite Pharma引进的CD19-CAR-T疗法FKC889登记启动一项II期临床,评估用于治疗复发性/难治性(r/r)套细胞淋巴瘤(MCL)的有效性和安全性。试验的主要研究者由北京肿瘤医院医学博士朱军担任。2020年7月和12月,Tecartus®(FKC889)已在欧美获批上市,是目前唯一一个获批用于这类患者的CAR-T。在关键临床中,中位随访为17.5个月时,该新药的客观缓解率(ORR)为 92%,其中完全缓解(CR)率为 67%。
6.复宏汉霖TIGIT单抗获批临床。复宏汉霖自主研发的TIGIT单抗HLX53获国家药监局临床试验默示许可,拟开发用于治疗晚期/转移性实体瘤或淋巴瘤。研究表明,HLX53可与人TIGIT特异性结合并阻断TIGIT/PVR结合而产生的下游负向信号,重新激活T细胞对肿瘤的免疫应答效应。HLX53是复宏汉霖第二款TIGIT靶点新药获批临床,该公司此前已有一款PDL1/TIGIT双抗HLX301处于I/II期临床阶段。
国际药讯
1.赛诺菲庞贝病第二代ERT疗法获欧盟批准。欧盟委员会(CE)批准赛诺菲第二代酶替代疗法(ERT)Nexviadyme(avalglucosidase alfa,neoGAA)上市,用于长期治疗庞贝病,包括晚发型庞贝病或婴儿型庞贝病。在一项Ⅲ期临床COMET(NCT02782741)中,与标准护理药物Lumizyme相比,Nexviazyme组患者第49周时预测的用力肺活量(FVC)百分比较基线改善(2.9分vs2.4分)达到非劣效性标准(p=0.0074;95% CI,-0.13,4.99)。
2.吉利德CD19 CAR-T新适应症获欧盟批准。吉利德旗下细胞治疗公司凯特制药开发的CD19-CAR-T疗法Yescarta(axicabtagene ciloleucel)获欧盟委员会(EC)批准新适应症,用于治疗三线或以上系统治疗后的复发/难治性(R/R)滤泡性淋巴瘤(FL)。一项Ⅱ期临床ZUMA-5(NCT03105336)数据显示,在R/R FL患者中(n=75),Yescarta的总缓解率(ORR)为91%,CR为77%。中位DoR为38.6个月,24个月仍有缓解的患者比例为56%。
3.阿斯利康PD-L1抑制剂达Ⅲ期主要终点。阿斯利康PD-L1抗体Imfinzi(durvalumab)联合新辅助化疗药物,治疗肿瘤可切除型IIA-IIIB期非小细胞肺癌的国际Ⅲ期临床AEGEAN中期结果积极。与安慰剂相比,Imfinzi联合化疗可在统计上显著地改善患者病理学完全缓解(pCR)和主要病理缓解(MPR)。该试验将继续分析无事件生存期(EFS)等其他主要终点。Imfinzi联合新辅助化疗的安全性结果与之前研究一致。
4.长效GLP-1激动剂短肠综合征临床积极。9 Meters Biopharma公司长效性GLP-1受体激动剂vurolenatide在治疗短肠综合征(SBS)的Ⅱ期临床VIBRANT结果积极。数据显示每月只需接受两次Vurolenatide治疗,便可降低患者的总排便量(TSO)。在11例患者中,有7例患者实现与基线相比的24小时的平均TSO至少下降10%或更多。在Ⅲ期试验所选定的剂量中,患者平均TSO下降量大于25%。此外,Vurolenatide的总体耐受性良好。
5.强生CD3/GPRC5D双抗获FDA突破性疗法认定。FDA授予强生旗下杨森公司双抗药物talquetamab突破性疗法资格,用于治疗接受过包括蛋白酶体抑制剂、免疫调节剂和抗CD38抗体在内至少4种治疗方案的复发或难治性多发性骨髓瘤。Talquetamab是一款潜在“first-in-class”、即用型T细胞重定向双抗,同时靶向GPRC5D和CD3。该新药此前已获得FDA授予的孤儿药资格和EMA授予的优先药物资格。
6.赛诺菲BTK抑制剂III期临床遭FDA叫停。FDA暂停赛诺菲BTK抑制剂tolebrutinib用于治疗复发性多发性硬化症(MS)、重症肌无力(MG)、非复发性继发进展性MS和原发性进展性MS等多项III期临床。此次暂停是因为发现接受tolebrutinib治疗的患者中出现药物性肝损伤病例。Tolebrutinib是首个完成用于治疗MS概念验证研究并率先进入III期阶段的BTK抑制剂,赛诺菲对tolebrutinib用于MS适应症开发充满信心。
医药热点
1.复旦肿瘤医院肾癌患者5年生存率超77%。7月1日,复旦大学附属肿瘤医院在上海召开的2022年浦江肾脏肿瘤高峰论坛上发布该院肾癌患者随访结果。数据显示,在复旦大学附属肿瘤医院接受治疗的I期、II期、III期肾癌患者5年生存率分别高达93%、82%、64%,IV期患者的5年生存率接近30%,各分期总5年生存率达77.1%,均处于国际领先水平。在美国,肾癌手术量最大、治疗效果最好的癌症中心为美国克利夫兰医学中心,该中心的肾癌5年生存率为74%。
2.2022年版猴痘防控技术指南出台。国家卫健委日前印发《猴痘防控技术指南(2022年版)》,旨在进一步指导各地做好猴痘疫情防控工作,规范猴痘流行病学调查、接触者判定和管理、实验室检测等工作。指南指出,各地应主动对入境人员进行猴痘病毒排查,特别是入境前21天内有猴痘疫情报告国旅居史的人员,密切监测出疹情况,发现可疑人员或疑似病例,应按相关规定及时报告辖区疾控机构并转送定点收治医疗机构。
3.北京鼓励医疗机构开设黄昏门诊。北京卫健委29日发布《2022年北京市改善医疗服务行动计划》。《行动计划》要求,综合医联体核心医院、三级医院全部门诊预约号源,在其常规放号时间2周前,向北京市基层医疗卫生机构开放预约挂号;年内紧密型儿科医联体成员单位达到25家以上,具备条件的二级以上综合医院要开设儿科门诊;鼓励三级医院大型设备预约权限下发社区。各医疗机构要加强医务人员出诊管理,鼓励开设黄昏门诊、夜间门诊和周末门诊,优化号源供给结构,引导患者错峰就诊。
评审动态
1. CDE新药受理情况(07月02日)
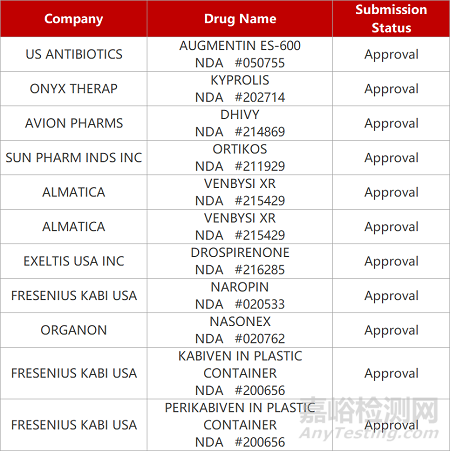
2. FDA新药获批情况(北美07月30日)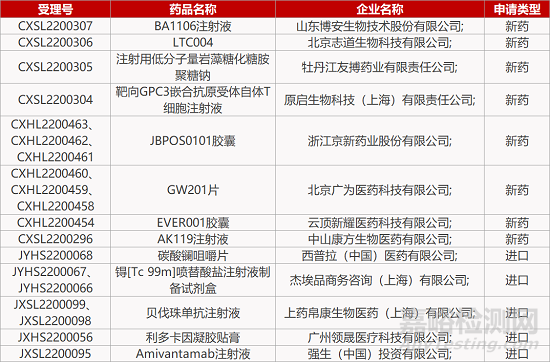

来源:药研发


