您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-09-24 08:13
在市场、技术、时间等因素的催化下,国产医疗器械产品扎根东南亚市场指日可待!
从人口数据看,东南亚人口合计超过6.2亿,约是美国人口的两倍,可知这是一个不可限量的市场。
从东南亚人口的疾病角度看,由于东南亚国家较为追崇西方的饮食文化,饮食过度与快餐饮食等不健康的生活习惯,则易增加糖尿病,心脑血管疾病等风险。其次,东南亚国家的人口老龄化日趋严重,据数据显示,至2050年,老龄化将增长60%。
从东南亚日渐增长的医保方面看,东南亚国家在近几年都有上调医保额度,如泰国从人均73美元增长至220美元,印度从人均36美元上升至人均150美元,且在2020年印尼的医疗保健产业从250亿美元增长500亿美元。东南亚国家对医保的重视程度越来越高,也从侧面反应出医疗器械对东南亚国家人口的重要性。
新加坡、泰国、马来西亚等多个东南亚国家在购买医疗器械产品较往年皆有所增长。
我们来看看越南的医疗器械市场环境及准入政策。
01越南的医疗器械市场环境
2019年,越南医疗器械市场价值达14亿美元,成为亚太地区第九大医疗器械市场,越南作为东南亚国家联盟(简称:东盟)成员之一,中越贸易往来日益密切,据海关总署公开数据显示,2017年-2021年,我国与越南的医疗器械贸易总额持续增长。
(一)2022年第一季度我国医疗器械出口越南数据
1.总体情况
据中国海关总署公开数据显示,2022年第一季度,我国与东盟十国的医疗器械贸易总额达28.11亿美元,占我国医疗器械对外贸易总额的8.20%。其中,我国与越南的贸易总额为4.01亿美元,同比增长0.21%;出口额为3.11亿美元,同比下降4.47%;进口额为0.99亿美元,同比增长18.31%。
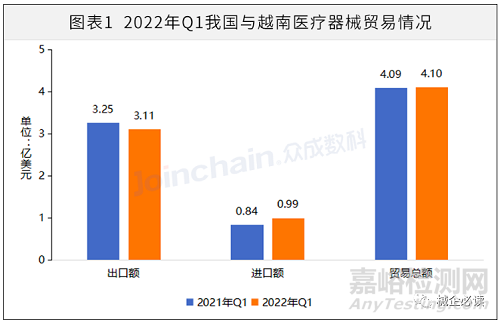
数据来源:中国海关总署,众成数科整理
2.品类分析
从出口医疗器械产品类型来看,2022年一季度我国出口越南金额占比最大的是医用耗材,出口额达1.59亿美元,占出口总额的51.31%。IVD试剂、医用敷料和诊疗设备的出口额增幅较大,其中IVD试剂的出口额为9599.82万美元,同比增长高达3213.61%;医用敷料的出口额为428.53万美元,同比增长146.33%。
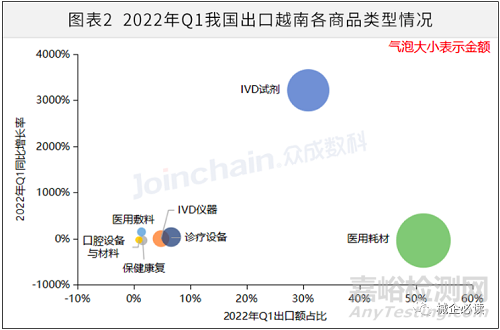
数据来源:中国海关总署,众成数科整理
3.省份分析
2022年一季度我国与越南医疗器械贸易往来中,贸易总额排行前三的省市分别为广东省(1.04亿美元)、上海市(5934.92万美元)和北京市(4156.11万美元)。在出口方面,广东省以9770.89万美元位居首位,占全国出口越南总额的31.46%;广西壮族自治区和浙江省分别以出口额3414.16万美元和3046.63万美元位列二三,占比分别为10.99%和9.81%。2022年一季度向越南出口医疗器械增幅最大的是湖北省,出口额为2841.86万美元,同比增长1475.92%。
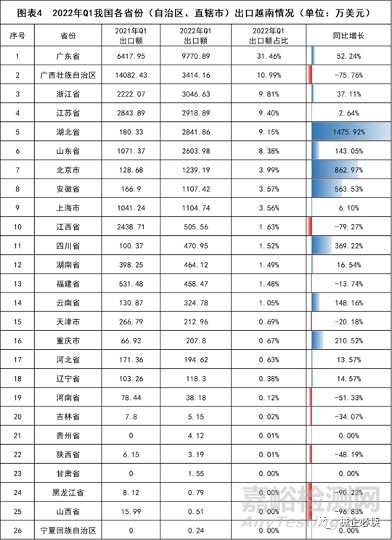
数据来源:中国海关总署,众成数科整理
随着越南政府越来越重视医疗发展,不断鼓励民间资本投建医院,加上越南人口众多,对医疗器械需求量大,因而具有相当庞大的医疗器械市场发展潜力,我国出口越南医疗器械市场存在巨大机遇。
02 越南的医疗器械市场准入政策
自2016年7月1日起,越南医疗器械统一由越南卫生部(Ministry of Health, MOH)下设的医疗器械及健康工作局(Department of Medical Equipment and Health Works, DMEHW)专责管辖,负责医疗器械相关的注册上市、进口、临床试验、上市后监管等工作。2021年11月,越南卫生部发布了《第98/2021/ND-CP号有关医疗器械管理法令》(以下简称“《第98号法令》”或“新法令”),于2022年1月1日开始实施,取代原2016年实施的《第36/2016/ND-CP号有关医疗器材管理法令》及另外两部相关的补充法令(以下合称为“《第36号法令》”或“原法令”)。
越南这次对医疗器械管理法令的修改在产品注册方面有重大突破,包括:
(一)产品分类
越南的医疗器械按照风险评估高低,分为两大类及四种等级:
第一大类:包含A等级(低风险),如医疗器材,如轮椅、绷带。
第二大类:包含B等级(平均风险较低,如血液离心机、注射针头)、C等级(平均风险较高,如诊断用X光设备、输尿管支架)及D等级(高风险,如可吸收缝线、牙科植体、心律调节器)医疗器材。
根据原法令,医疗器械产品在申请注册之前,需聘请经认证的越南当地组织或个人进行医疗器械的产品分类,申请人在获得分类文件后方可提交产品注册申请。而在新法令下,申请人可以自行进行产品分类,并直接作为产品注册申请的一部分一并提交申请。
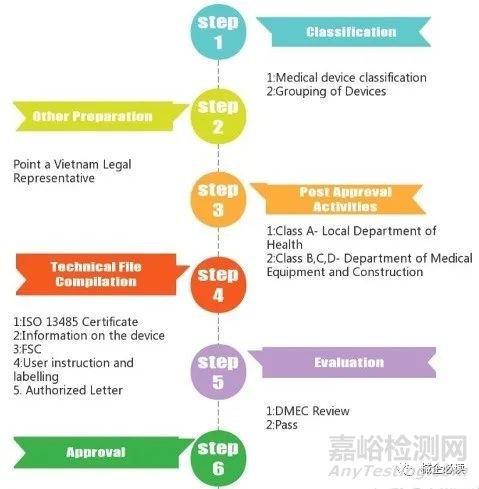
越南医疗器械审批流程
(二)进口许可
越南大部分产品无需进口许可,根据规定仅部分产品进口时获得许可。根据原法令,一般需要进口许可的亦多属于C和D类产品(如呼吸机、婴儿保育箱、起搏器、X光机、MRI、血液透析设备等),原法令下,这些产品在申请进口许可后无需再申请上市许可。新法令将进口许可和上市许可进行了统一,即只要申请上市许可,而无需另行申请进口许可。
(三)参考国家批准
原法令下,持有美国、加拿大、欧洲、日本或澳大利亚中任一国家的医疗器械上市许可审批的医疗器械,在向越南提交注册时可适用快速审查流程,豁免技术审查。新法令增加中国和韩国为前述参考国家之一,也即,若某一医疗器械产品已获得我国国家药品监管局签发的医疗器械注册证的,则在越南注册上市时亦可适用快速审查流程,豁免技术审查,这将使得申请人的审批等待时间从60个工作日缩短为10个工作日。
(四)注册许可有效期限
原法令下,A等级产品的注册许可永久有效,而B、C、D等级产品的有效期为五年,且到期前一年需履行更新手续。在新法令下,所有等级的注册产品均永久有效,除非此等法令被变更。
(五)注册持有人要求
新法令要求境外医疗器械生产企业须指定并授权越南当地企业提交注册申请并担任注册持有人。注册持有人可以授权无数量限制的经销商实施进口以及参与公开招标。这一新规定与我国的相关规定有相似之处,即要求境外企业委托一位境内企业法人提交注册申请(注:根据2021年修订的《医疗器械监督管理条例》,境外企业不能再委托其境内代表处执行此工作)。不同点在于,越南指定的代理人实际为注册证持有人,履行注册持有人义务。
而在我国,虽然境外企业的境内代理人承担诸如不良反应、产品召回的连带责任,但注册持有人身份并不转移给境内代理人。因此,在我国实践中常见一些境外企业聘用非关联的经销商作为其境内代理人。越南的这一规定则将促使境外医疗器械生产企业在越南设立子公司,以控制注册持有人之权利。
总体而言,越南新法令简化了产品注册方面的合规要求,缩短了的产品注册审批时间,这些法规的变化有助于促进越南医疗器械行业的进一步发展,也为我国医疗器械打入越南市场减轻了不小的阻碍。例如,近日,凯利泰 “可弯曲椎体扩张成形器”在越南注册获批,取得越南的永久有效证书。
“出海”,是医疗器械企业发展的全新征途!

来源:械企必读


