您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-10-09 15:31
今日,国家药监局器审中心发布《基于高通量测序技术的非小细胞肺癌相关基因变异检测试剂临床试验注册审查指导原则(征求意见稿)》
基于高通量测序技术的非小细胞肺癌相关基因变异检测试剂临床试验注册审查
指导原则(征求意见稿)
本指导原则旨在指导注册申请人对基于高通量测序技术的非小细胞肺癌相关基因变异检测试剂临床试验的设计及开展,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是针对基于高通量测序技术的非小细胞肺癌相关基因变异检测试剂临床评价的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要详细阐明理由,并对其科学合理性进行验证,提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则所阐述的基于NGS技术的NSCLC基因变异检测试剂,是指采用NGS技术检测NSCLC患者福尔马林固定石蜡包埋组织样本中的基因变异状态的体外诊断试剂(以下简称“申报产品”)。
本指导原则适用于进行首次注册申报和相关许可事项变更的产品。
有关此类产品的背景信息以及本指导原则适用范围确定的依据参见附件。
二、临床试验设计
(一)临床性能研究
1.临床试验机构及人员
申请人应选择不少于3家经医疗器械临床试验机构备案的临床机构开展临床试验。临床试验机构应具有病理诊断、分子生物学等检测的优势,实验操作人员应有足够的时间熟悉检测系统的各环节(仪器、试剂、质控及操作程序等),熟悉评价方案。临床试验整个过程均应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
2.临床试验适用人群和样本类型
适用人群为经病理诊断为NSCLC的人群。应注意纳入NSCLC不同分期的病例,应包括Ⅰ~Ⅳ;同时应纳入不同的组织分型(包括腺癌、鳞癌、腺鳞癌以及大细胞癌)等。阳性样本应包括不同突变率的样本。所纳入人群应在各年龄段均有分布。
临床试验所用的样本类型应为FFPE样本。如对于穿刺标本及手术标本均适用,则临床试验中对于两种标本均应纳入。临床样本的处理、保存和核酸提取等应分别满足申报产品说明书及对比试剂说明书的相关要求。
3.对比方法的选择
可选择参考方法或已上市同类产品作为对比方法。参考方法的检测可在临床试验机构完成也可委托具有资质的第三方机构完成。对比方法的选择应从预期用途、样本要求、检测性能、检测范围、所检突变是否可以分型等方面,确认其与申报产品具有较好的可比性。也可以采用多种对比方法来分别进行对比。
4.最低样本量
临床试验样本量应采用适当的统计学方法进行估算,并详细描述所使用统计方法及各参数的确定依据。此部分临床试验目的为评估两种检测方法之间的一致性,因此建议采用单组目标值法进行最低样本量的估算。通过阳性符合率和阴性符合率来分别计算所需阳性样本和阴性样本的例数,应针对每个基因分别进行样本量的估算。
阴、阳性符合率的临床可接受标准(P0)建议不低于90%。当评价指标PT接近100%时,该样本量估算方法可能不适用,应考虑选择更加适宜的方法进行样本量估算和统计学分析,如精确概率法等。
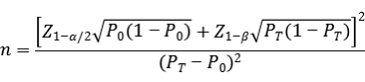
公式中,n为样本量;Z1-α/2、Z1-β为显著性水平和把握度的标准正态分布的分数位,P0为评价指标的临床可接受标准,PT为申报产品评价指标预期值。
应对申报产品所声称的每个基因的各种突变均进行验证,且每种突变类型均应具有一定例数。对于个别临床发生率较低的突变,可结合申报产品的检测原理(如是否共用相同的引物及捕获探针等)及申报产品的检测性能等综合考虑。
临床试验总样本量确定时应在上述阴、阳性样本最低样本量估算的基础上,同时考虑其他可能造成受试者脱落的情况以及申报产品所覆盖的所有突变位点应尽量均纳入,根据实际情况适当增加入组样本量。
5.统计分析
首先应针对所入组人群进行人口学分析,包括性别、年龄、治疗状态、组织分型、分期、入组类型、样本类型(穿刺标本或手术标本)、肿瘤细胞含量、覆盖所有基因亚组等方面进行分析,还应分析临床试验中所纳入的阳性判断值附近的样本情况。
以四格表分别总结申报产品与对比方法的定性检测结果,计算阳性符合率、阴性符合率及相应的95%置信区间。除总体统计外,还要针对每个基因、每种突变进行统计分析,以验证申报产品与对比方法检测结果的一致性。
对于融合,应分别统计每种融合类型的例数,常见的融合类型应有一定例数。
同时应针对存在混合突变的样本单独进行统计分析。
针对不一致样本,应采用合理的方法进行确认,对不一致的原因综合进行分析。
(二)临床意义的确认
1.具有明确伴随诊断意义的基因变异
针对具有明确伴随诊断意义的基因变异,如EGFR (19del、L858R、T790M)、ALK融合、ROS1融合、MET 14外显子跳跃突变、RET融合等,应参考伴随诊断相关指导原则提供伴随诊断临床证据。
1.1 一致性比对
针对EGFR、ALK融合、ROS1融合,如申报产品为针对已上市的抗肿瘤药物所开发的非原研伴随诊断试剂,则可按照相关指导原则的要求,采用与原研伴随诊断试剂进行一致性比对的方式开展临床试验,也可采用指导原则中的其他评价路径。
1.1.1临床试验机构的数量
针对此部分临床研究,申请人应选择不少于3家经医疗器械临床试验机构备案的临床机构开展临床试验。
1.1.2对比方法的选择
应选用申报产品所声称伴随的抗肿瘤药物的原研伴随诊断试剂作为对比试剂。常见的NSCLC抗肿瘤药物及其所对应的原研伴随诊断试剂如下:
|
基因变异 |
抗肿瘤药物 |
原研伴随诊断试剂 |
|
EGFR 19 del、L858R |
特罗凯(厄洛替尼) |
罗氏:EGFR基因突变检测试剂盒(等位基因特异扩增荧光PCR法) |
|
EGFR 19 del、L858R |
易瑞沙(吉非替尼) |
凯杰:therascreen® EGFR RGQ PCR Kit |
|
EGFR 19 del、L858R |
吉泰瑞(阿法替尼) |
凯杰:therascreen® EGFR RGQ PCR Kit |
|
EGFR T790M |
泰瑞沙(奥希替尼) |
罗氏:EGFR基因突变检测试剂盒(等位基因特异扩增荧光PCR法) |
|
ALK融合 |
赛可瑞(克唑替尼) |
雅培:ALK基因重组检测试剂盒(荧光原位杂交法) |
|
ROS1融合 |
赛可瑞(克唑替尼) |
厦门艾德:人类ROS1基因融合检测试剂盒(荧光PCR法) |
应注意,申报产品所声称的基因变异位点应与原研伴随诊断试剂具有一致性,超出原研伴随诊断试剂检测范围的突变位点不可作为指导用药的依据或提供伴随诊断意义的临床证据。
申报产品用于指导用药的灵敏度应与原研伴随诊断试剂相当,根据原研伴随诊断试剂的灵敏度水平设置相应的阳性判断值,以保证两者具有较好的一致性。
1.1.3 入组人群
此部分临床研究的目的在于评价申报产品的伴随诊断的预期用途,因此所入组人群应以申报产品所声称的伴随的抗肿瘤药物的适应证人群为主。如药物的适应证人群临床上较少,客观上无法实现,则临床试验中也应包含一部分药物的适应证人群。
1.1.4 样本量要求
样本量的估算方法与上述临床性能评价中的样本量估算方法相同,根据与原研伴随诊断试剂的一致性水平设置合理的最低可接受标准。如原研伴随诊断试剂同时能够满足对申报产品临床性能的评价,则此部分研究可与第一部分临床性能的评价进行合并,但应注意入组人群的差异。
如采用与原研伴随诊断试剂的外部等效性研究进行伴随诊断用途的验证,应采用合理的统计学模型进行样本量的估算,样本量应能够满足考核试剂和原研伴随诊断试剂检测结果之间的符合率非劣效于两次原研伴随诊断试剂检测结果之间的符合率的要求。应注意在统计分析过程中非劣效性界值的确定应能够满足临床需求,并提供非劣效界值的确定依据。
此部分研究中应根据适应证人群中的基因突变率纳入临床常见的变异类型。
1.1.5 统计分析
此部分研究的目的在于评价申报产品与原研伴随诊断试剂在适应证人群中筛选人群的一致性,因此除了应按照不同突变(如EGFR 19del、L858R)进行统计分析外,还应对申报产品与原研伴随诊断试剂对于用于筛选人群的生物标志物的不同突变汇总统计(EGFR 19del+L858R)。
如伴随诊断用途的验证采用与原研伴随诊断试剂进行比较的外部等效性研究的评价方法,应采用特定的统计学方法进行统计分析,即:评价同时与原研伴随诊断试剂的第一次检测结果相比,申报产品和原研伴随诊断试剂的第二次检测结果的阳性符合率的差值和阴性符合率的差值的95%置信区间上限是否小于预先设定的非劣效界值。
1.2 桥接试验及药物疗效观察性研究
对于MET 14外显子跳跃突变、RET融合,根据伴随诊断相关指导原则目前尚不能进行一致性比对的路径提供伴随证据,可选择桥接试验或药物疗效观察性研究的路径进行伴随诊断意义的验证。
1.3 与抗肿瘤药物同步研发的伴随诊断试剂
如申报产品为与新开发的抗肿瘤药物同步研发的伴随诊断试剂,则可提供与药物同步开发的药物临床试验资料作为其伴随诊断证据。药物临床试验报告中应明确所使用的伴随诊断试剂为申报产品,并明确申报产品在药物临床试验中所起的作用以及与药物疗效的关系。
2. 具有临床意义的基因变异
基于NGS方法的检测能力及技术特点,对于尚不是伴随诊断的基因变异位点,但经临床诊疗指南公认为具有临床意义的基因变异亦可以纳入其检测范围。
针对此类基因变异,对于有已上市同类产品的,无需提供其临床意义的证据。如尚无已上市同类产品的,申请人应提供针对NSCLC患者的临床诊疗指南等临床公认的相关资料作为该类基因变异位点临床意义的支持性资料。
(三)通用要求
1.临床试验方案
临床试验实施前,研究人员应从流行病学、统计学、临床医学、检验医学等多方面考虑,设计科学合理的临床试验方案。各临床试验机构应执行统一的临床试验方案,且保证在整个临床试验过程中遵循预定的方案实施,不可随意改动。整个试验过程应在临床试验机构的实验室内并由本实验室的技术人员操作完成,申报单位的技术人员除进行必要的技术指导外,不得随意干涉实验进程,尤其是数据收集过程。
试验方案中应确定严格的病例纳入/排除标准,任何已经入选的病例再被排除出临床试验都应记录在案并明确说明原因。在试验操作过程中和判定试验结果时应采用盲法以保证试验结果的客观性。
2.质量控制
临床试验开始前,建议进行临床试验的预试验,以熟悉并掌握相关试验方法的操作、仪器、技术性能等,最大限度控制试验误差。整个试验过程都应处于有效的质量控制下,最大限度保证试验数据的准确性及精密度。
3.临床试验报告
临床试验报告应该对试验的整体设计及各个关键点给予清晰、完整的阐述,应该对整个临床试验实施过程、结果分析、结论等进行条理分明的描述,并应包括必要的基础数据和统计分析方法,最后得出临床试验结论。临床试验报告的撰写参考《体外诊断试剂临床试验技术指导原则》的相关要求。
报告中应明确所配套使用的测序仪、生物信息数据分析软件、测序试剂等具体信息。
数据汇总表中应提供唯一可溯源的样本编号、基本人口学信息(性别、年龄等)、临床诊断背景信息、肿瘤的病理分型、分期、组织样本肿瘤细胞占比、突变类型、突变频率、测序深度、reads数、申报产品及对比方法的检测结果等信息。
委托第三方机构进行参考方法检测的,应提供临床试验机构与第三方机构的委托协议。同时应提供参考方法的详细资料,如:方法原理、所需试剂及仪器、参考方法的性能验证、参考方法质控、典型的实验图谱及数据等。上述资料应由临床试验机构签章确认。
三、参考文献
[1] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Non-Small Cell Lung Cancer, Version 7.2021 — October 29, 2021.
[2]中国临床诊疗学会(CSCO)非小细胞肺癌诊疗指南 2022.
[3]中国临床肿瘤学会非小细胞肺癌专家委员会,二代测序技术在NSCLC中的临床应用中国专家共识(2020版)[J].中国肺癌杂志,2020,23(9):741-761.
[4]中华医学会病理学分会等,非小细胞肺癌分子病理检测临床实践指南(2021版)[J].中华病理学杂志,2021,50(4):323-332.
[5]《抗肿瘤药物的非原研伴随诊断试剂临床试验注册审查指导原则》(国家药品监督管理局2021年第95号)[Z].
[6]《与抗肿瘤药物同步研发的原研伴随诊断试剂临床试验注册审查指导原则》(国家药品监督管理局医疗器械技术审评中心2022年第28号)[Z].
四、起草单位
国家药品监督管理局医疗器械技术审评中心
附件:
关于基于高通量测序技术的非小细胞肺癌相关基因变异检测试剂
的背景介绍
基于高通量测序(high-throughput sequencing)即下一代测序(next generation sequencing,NGS)的技术,检测肿瘤组织中的基因变异,正在广泛用于肿瘤诊疗相关领域。肿瘤基因变异类型包括点突变、插入、缺失、基因重排、拷贝数异常等。尤其精准医疗的蓬勃发展,在抗肿瘤药物的伴随诊断领域也起到了至关重要的作用。
肺癌是我国发病率和死亡率最高的恶性肿瘤,按照病理学分类,可分为非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC)两种类型,其中NSCLC是最为常见的组织学类型,约占85%。随着分子生物学技术的发展,对于NSCLC的认识已经从组织水平发展到了分子水平,越来越多的肿瘤相关基因变异被发现,基于基因变异的靶向治疗在NSCLC的抗肿瘤治疗中起到了显著的临床效果。目前在NSCLC中的肿瘤相关突变基因主要有以下基因:
EGFR:人表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)突变是NSCLC驱动基因研究中最早发现的基因变异,也是NSCLC中最常见的驱动基因变异。EGFR是一种跨膜酪氨酸激酶受体,该受体激酶域激活与癌细胞增殖、转移和凋亡等多种信号传导通路有关。EGFR突变率在亚洲人群晚期肺腺癌患者中的发生率高达50%,该基因的常见突变位点发生在18号~21号外显子上,其中最常见的是19号外显子缺失突变(19del)以及21号外显子L858点突变(L858R),这两种突变占比约为90%,均为EGFR酪氨酸激酶抑制剂(Tyrosine Kinase Inhibitor,TKI)敏感型突变。20号外显子上的T790M替代突变为一代TKI的耐药突变。此外,还有许多类型的突变临床意义尚不明确。
ALK:间变性淋巴瘤激酶(Anaplastic Lymphoma Kinase, ALK)基因融合在NSCLC中的发生率约为5%~10%,其中EML4是最常见的ALK融合伴侣,占ALK 重排的90%~95%。EML4-ALK又分为多个亚型,其中V1型(E13:A20)和V3型(E6:A20)占比最高,约占EML4-ALK融合突变的75%~80%,其次为V2型(E20:A20),其他EML4-ALK融合亚型则较为少见(占比均不足10%)。ALK靶向抑制剂对ALK基因融合阳性的晚期NSCLC患者具有显著疗效。除EML4这一最常见的融合伴侣外,研究还发现KIF5B、TFG、KLC1、SOCS5、HIP1、TPR、BIRC6等多种罕见的ALK融合伴侣,这些罕见的融合并未有充分的药物研究。
ROS1:ROS1位于人类6号染色体长臂上,全称c-ros原癌基因,是跨膜酪氨酸激酶受体家族成员之一。发生融合的ROS1蛋白失去了大部分细胞外结构域,不需要配体结合便可被持续激活,导致下游信号通路功能异常。ROS1融合在NSCLC中的发生率约为2%,重排位点主要发生在32号~36号外显子,最常见的ROS1融合伴侣是CD74、SLC34A2、CCDC6和FIG。临床上作为克唑替尼等药物的检测靶点。
MET:c-MET为一种表达于上皮细胞和内皮细胞表面的受体酪氨酸激酶,可被其配体干细胞生长因子(HGF)激活,在肿瘤细胞的生长、增殖、侵袭及抑制细胞凋亡方面发挥重要作用。c-MET通路异常激活主要包括MET 14号外显子跳跃突变、MET扩增和MET蛋白过表达3种类型。目前已有针对MET 14号外显子跳跃突变晚期NSCLC患者的靶向药物获得批准,并且有多个新药已处于临床研究阶段。
RET:RET原癌基因位于第10号染色体长臂,编码一种具有酪氨酸激酶活性的单次跨膜糖蛋白受体。RET激酶受体可通过细胞内酪氨酸残基的自磷酸化激活,触发包括RAS-MARK、PI3K-AKT、JAK-STAT等于细胞增殖及存活相关的信号通路。RET基因变异主要有两种形式,点突变及基因融合。RET基因融合常见于NSCLC,在NSCLC中的发生率约为1.4%~2.5%,其中KIF5B-RET为最常见的RET融合,约占68.3%,其次为CCDC6-RET(16.8%)、NCOA4-RET(1.2%)。RET融合基因为靶向药物的研发提供了靶点,目前国内已有针对NSCLC的RET抑制剂获批上市。
BRAF:BRAF突变可导致MAPK/ERK信号通路异常活化,在NSCLC中突变频率为1%~2%,常见突变位型为V600E,约占50%以上。一般认为,BRAF V600E突变可能是NSCLC的不良预后因素。
KRAS:KRAS在亚洲人群中突变率为8%~10%,突变位点位于2号及3号外显子。研究表明,KRAS突变可能与患者预后差、耐药等相关。
ERBB2(HER2):HER2是酪氨酸激酶受体ERBB家族成员之一,在NSCLC中最常见的突变是20号外显子插入突变,在NSCLC中的突变率为2%~4%。研究显示,小分子TKI对HER2突变型的晚期NSCLC患者的疗效不佳。
基于NGS技术高通量的特点,并且可检测的变异类型多样, 随着研究的深入,会有越来越多的具有临床意义的基因变异被发现。目前在NCCN及我国相关非小细胞肺癌诊疗指南中推荐检测的主要为以上基因变异,考虑到中国NSCLC患者特有的基因变异频率、药物在中国的获批适应证及药物可及性,CSCO NSCLC诊疗指南(2022)中对不可手术的晚期NSCLC患者,检测分子标志物EGFR突变、ALK融合、ROS1融合、RET融合以及MET 14外显子跳跃突变作为Ⅰ级推荐。相关的专家共识中亦建议至少应同时检测EGFR突变、ALK融合和ROS1融合三种形式的基因变异。

来源:中国器审


