您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-19 21:29
推进创新药同步研发、注册与审评,构建中国医药创新生态系统
——临床研究高效性及临床能力建设
Promoting Simultaneous R&D, Registrationand Review of Innovative Drugs, Fostering Pharmaceutical Innovation System in China
- Effectiveness of Clinical Research and Clinical Capacity Building
摘 要 Abstract
推动创新药同步研发、注册与审评对构建我国医药创新生态系统具有重要意义,需要多方机构/组织在多个环节的高效互动与合作。在“注册监管科学性”之外,本文继续聚焦“临床研究高效性”。当前我国临床研究高效性主要受到临床方案执行与临床研究能力的双重挑战,这对临床试验机构内部流程和彼此间的协同以及伦理审批的效率和水平均提出更高要求,同时需要科学合理的体系保障为高质高量的临床研究保驾护航。同时,针对临床能力建设,本文分析了临床人才培养和数字化工具平台建设等的现状并进行了展望。
Promoting simultaneous R&D, registration and review of innovative drugs is of great significance to the construction of China's pharmaceutical innovation ecosystem, which requires efficient interaction and cooperation between multiple institutions/organizations in multiple areas. In addition to the "scientificity of registration supervision", this paper continues to focus on the "effectiveness of clinical research". At present, the effictiveness of clinical research in China mainly faces the dual challenges of clinical protocal implementation and clinical research capacities, which sets higher requirements for the internal processes and synergy within and between clinical trial institutions and the efficiency and level of ethical approval, and at the same time requires scientific and reasonable system to support high-quality and high-volume clinical research. At the same time, in view of clinical capacity building, this paper analyzes the current situation of clinical talent training and digital tool platform construction and makes prediction.
关键词 Key words
临床研究;伦理审批;机构流程;临床能力建设;数字化工具
clinical research; ethical approval; institution process; clinical capacity building; digital tool
一、临床研究高效性:现状和当前挑战
(一)我国临床试验机构的整体现状
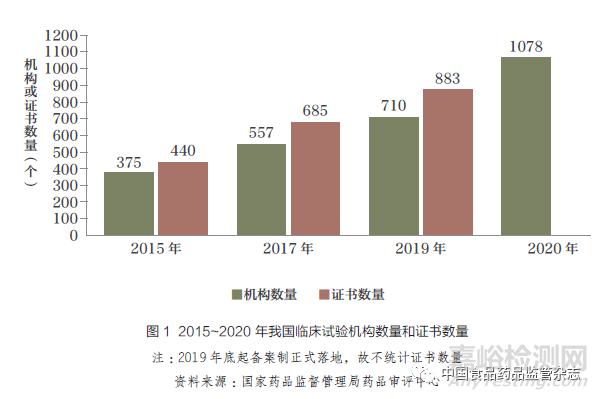
在鼓励医药创新的各项政策推动下,我国临床试验数量快速上升:2019 年,我国药物临床试验数量超过1600 个,相比2009年的临床试验数量增长超过20倍。2015~2020 年, 我国临床试验机构数量也在稳步增长,从2015 年的375 家增加到2020年的1078 家,在一定程度上承接了增长的临床研究需求(图1)。
尽管机构数量近年来稳步上升, 但是多数临床试验机构的过往经验仍普遍不足。在2019~2020 年承担超过20 项临床试验的机构不到2020 年机构总数的30%(图2)。我国临床试验机构承担国际多中心临床试验的经验更为匮乏,仅有6% 的机构在2 年内承担超过20 项国际多中心临床试验(图3)。随着我国在全球创新药市场地位的提升,国际多中心临床试验的需求未来会进一步增长,提升临床研究的高效性,将为推进同步研发提供重要保障。


(二)临床研究高效性的主要挑战
临床研究高效性包括临床方案执行与临床研究能力两大重要维度,主要影响临床研发阶段的效率与质量。临床方案执行的关键痛点包括:临床试验加速启动受到试验机构和申办方相关流程的限制、区域伦理和中心伦理审查机制有待完善。临床研究能力的关键痛点包括:临床试验机构和研究者的整体临床试验管理和与风险匹配的适应性管理有待升级、确保临床研究可执行性的临床试验机构设置(包括研究平台、研究型病房、专职临床研究团队建设)有待强化、早期探索性临床试验管理经验与能力不足、申办方临床研究的理念和能力有待加强、第三方服务机构整体能力及监督管理水平有待提升。
1. 临床方案执行的挑战
临床试验加速启动受到试验机构和申办方相关流程的限制。目前我国临床试验启动阶段耗时较长,主要痛点体现在机构内管理流程繁琐、机构间流程统一不足、申办方内部效率不高三方面。机构内管理流程繁琐:机构立项、伦理审批和合同签订方面都有一定程度制约,成为落实临床试验的一个限速步骤。在某些情况下,机构合同存在与临床试验机构无直接关系的问题(如知识产权相关问题、试验数据相关问题等),带来更高程度的复杂性,造成机构合同签署流程繁琐,时间线延误。机构间流程统一不足:各试验机构临床方案启动的流程程序和资料要求方面存在差异,导致申办方试验启动阶段准备工作的不确定性高,需针对不同试验机构开展定制化的准备工作,难以实现不同机构间临床方案启动的效率最优化,临床试验全面加速启动受到阻碍。申办方内部效率不高:除临床试验机构的相关因素外,申办方流程优化同样有待提升。目前申办方普遍存在临床试验启动的内部流程和沟通机制不够高效的情况,影响临床试验启动阶段合同签订的时间线。
区域伦理和中心伦理审查机制有待完善。尚未进一步落实2017 年中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[1] 中关于“完善伦理委员会机制”和“提高伦理审查效率”的具体措施。伦理审批流程滞后:仍有部分机构在临床申请获批之后才开展伦理审评审批,参与中心伦理审批的大部分机构需要在牵头中心伦理获批后方可进行本中心伦理审评审批,未实现充分平行(图4)。伦理审批协同不足:临床试验机构普遍缺乏对区域伦理和中心伦理审批的认可度,造成不同试验机构间伦理审批出现不必要重复。伦理审批考核缺乏:缺乏伦理审批效率的考核,影响审批部门的积极性。

2. 临床研究能力的挑战
临床试验机构和研究者的整体临床试验管理和与风险匹配的适应性管理有待升级。临床试验机构和研究者仍多关注受试者入组的绝对数量,而未充分从试验结果科学预期的角度出发开展临床研究,应树立按照入组标准入组合适受试者的理念并指导执行。研究者应加强依从研究方案和《药物临床试验质量管理规范》(GCP)原则进行受试者管理和文档管理,目前一线研究人员沿用常规诊疗操作和病历记录来管理临床研究的情况甚为普遍。另外,不同临床试验机构间的差异较大,部分机构管理环节复杂导致试验启动慢或无法开展,而另一些机构则对研究者的临床研究操作和质量缺乏质控和帮助。应基于ICH E6(R3)的精神,促进我国临床试验机构和研究者与风险相匹配的适应性,而非一味从严管理。
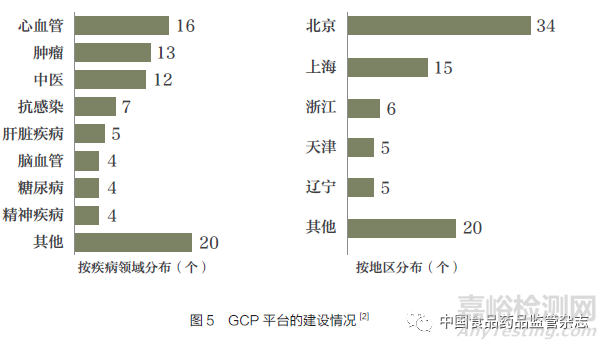
确保临床研究可执行性的临床试验机构设置有待强化。在“重大新药创制”科技重大专项支持下,我国GCP 平台在伦理委员会建设、信息化管理系统、临床评价实验室建设等方面近年来已取得了阶段性成就(图5)。但是,由于临床试验机构、研究者和申办方在人员能力和实施过程中质量把控存在不足,临床研究在方案设计水平和数据质量方面均有提升空间。
现阶段我国临床试验机构普遍缺乏专职的临床研究团队,在保证从事临床研究的时间及资源投入上存在挑战。研究者方面,主要由临床医生兼任临床研究者,考虑到所承担的繁重临床工作,可用于临床研究时间有限;另外,大部分医院缺乏专职临床研究护士和内部临床研究助理团队,尚未形成完备的临床试验机构内部团队。部分试验机构和研究者采用第三方提供的临床试验机构现场管理服务,监督管理的职责不明确,过多依赖第三方的临床研究协调员。重大新药创制和GCP平台建设大幅度提升了我国临床研究硬件设施,软技能方面的专业研究团队建设将成为研究中心能力提升的重点。
早期探索性临床试验管理经验与能力不足。早期探索性研究的参与,有利于我国更好地融入全球创新,从而实现更广意义上的同步研发;与此同时,也对我国临床研究能力和系统提出更高要求。考虑到早期研究周期较短并常常需要围绕生物标志物开展探索性研究,进而受到审批时间和人类遗传资源监管的影响,使得全球首创新药和首次人体试验的承担比例较少,目前我国临床试验机构和研究者在探索性临床试验方面经验普遍不足,研究中的科学管理和执行能力还有待提升(如对研究中不良事件的科学界定和处理等)。
申办方临床研究的理念和能力有待加强。申办方作为审评审批改革的受益方,应强化落实临床研究中的主体责任,并在各个环节充分考虑我国患者需求及执行实际。临床研究的设计方面,需要充分考量我国患者的未满足需求及针对性的临床试验;同时优化临床研究方案修订的流程,降低对整体时间线的影响。对于我国在全球研发中扮演的角色,不仅仅从贡献受试者入组数量的角度出发,还应更多地考虑探索性发现和对全球研发在设计上的作用。临床研究的执行方面,申办方内部需加强临床试验管理体系质量和效率的完善,优化申办方内部的协调、方案的修改流程和时间等;需要提高入组标准的严格执行以及临床跟踪检测的严谨性;另外,也需要加强临床运营中同临床试验机构的合作和对第三方服务机构的监管等。
第三方服务机构整体能力及监督管理水平有待提升。合同研究组织在临床研究中扮演重要角色,目前存在不同合同研究组织之间以及同一组织的不同团队之间能力差异较大的情况。现阶段的研发人才竞争激烈造成项目过程中人员流动,项目质量的保证受到挑战。另外,合同研究组织的监督管理体系尚不成熟,也增加了临床研究数据质量的风险。
二、临床研究高效性:未来展望
未来需要进一步优化临床研究执行流程,提高临床研究能力,并通过完善临床研究激励机制和资源投入等为强化临床研究构筑体系保障。
(一)临床研究执行
1. 优化临床研究执行中的机构内流程和机构间协同一致
临床试验机构的内部流程方面可以鼓励申办方同机构签订主协议,进而减少参与审评的部门。在机构队伍方面,可通过建立强化内部临床试验助理团队的方式,促进同申办方及合同研究组织对接沟通的效率提升。对于同一申办方在机构有多个项目的情况,可通过定期推进会的方式,梳理临床研究执行过程中的挑战并一同寻求解决的办法。另外,还需要明确合同审批的时限以缩短时间线并提高预期的确定性。
临床试验机构之间的流程统一对于临床研究项目的整体加速作用明显,可以通过卫生健康委等政府部门推进流程的标准化,并在标准化的基础上进行质量管控,将关键临床研究执行指标纳入机构整体管理指标和定期评估。
2. 推动伦理审批流程的简化并提高区域或中心伦理的效率和水平
伦理审批流程方面,需要进一步落实推进伦理审批和临床申请的同步;通过自上而下的方式,统一各医院伦理委员会审批所需资料与流程,并在医院层面对伦理审批的效率设定相应指标(如反馈时间和伦理委员会的开会频率等)。
伦理审批协同方面,推进中心化的伦理批准认可体系建设,包括区域伦理委员会的建设与临床试验机构对区域伦理委员会的认可度,以及同一系统内不同机构间的伦理互认。落实组长单位通过伦理审批后,其他临床试验机构优先认可组长单位的审批或简化审批以备案为主,避免重复审查;领先医疗机构承担中心伦理审批职责,当地二级医院等可以考虑委托给区域或中心单位。此外,还可以考虑建立申诉渠道;考虑有二级伦理的设置,由区域或中心伦理委员会承担伦理仲裁的角色。
伦理审批考核方面,需要推动形成伦理审批质量的认证标准,促进审评能力和审评质量方面的提升。
(二)临床研究能力
1. 推动临床试验机构平台打造
专业临床研究平台可以为临床研究设计、实施、质量控制、数据管理和分析等各方面提供技术支持,从而保障和提高临床研究的质量。当前,我国开展临床试验的研究平台相对匮乏,建立能够有效支撑临床研究的公共技术平台尤其重要。一是,临床试验机构平台可以让临床研究者在需要相关学科的支持时更及时得到帮助,在开展大规模多中心临床试验时,提供全面、全程和系统的技术支持。二是,临床试验机构平台还可以承载和发展相关学科,有利于聚拢相关专业人员,发挥各自所长,开展学术讨论,不断提高理论和技术水平,在更大范围内积累经验,形成示范效应。三是,临床试验机构平台可以作为难得的专业技术资源,在临床研究的质量控制和监管中发挥不可替代的作用。四是,临床试验机构平台可以对参与临床研究的人、财、物实施有效管理,保障临床研究的有效实施。五是,临床试验机构平台可以与医药产业实施有效对接,组织和承担企业创新产品相关的临床研究,对推动医药产业创新发展起到积极作用。
与此同时,可以考虑由有丰富临床科研经验的一二线城市医院牵头,与低线城市缺乏临床研究经验的医院结成临床研究联盟,一方面扩大所能覆盖的潜在受试者群体,另一方面也可以提升更多机构的临床研究能力。
2. 推动专职临床研究团队建设
推动专职临床研究团队建设需要在职业发展路径的打通和与工作内容相适应的考核体系建立这两方面发力。
在职业发展路径方面,需要在职称评定、继续教育、资格认证等方面为专职研究医生和研究护士等提供机会,并打通相应晋升通道。
在考核体系方面,需要保证参与临床研究人员的考核维度设计同其工作内容挂钩。
3. 促进机构明确定位,积累探索性临床试验的管理经验
考虑到探索性临床试验较高的能力需求,试验机构在能力建设中应基于明确自身的定位,找准率先突破的领域和解决的问题,进而制定相应目标和计划(如领先试验机构可聚焦更多资源到更高创新程度的项目)。
(三)临床研究体系保障
1. 临床研究激励机制
医院层面:优化考核体系,提升重视程度。优化考核体系:尽管三级医院评审现行标准和医院绩效考核现行政策被纳入临床研究相关指标,但权重不高,对医院科室排名贡献有限。从而造成在监管改革极大提升企业积极性的情况下,作为临床试验实施主体的医院积极性提升有限。提升重视程度:尽管临床医生对临床研究的重视程度逐年提高,但医院管理层的积极性还没有被充分调动,其所关心的重点还多在于承担国家级项目和发表科研论文的数量,而承担新药研发相当于国家自然科学基金的类似政策还未上升到国家层面。
医生层面:改革医生职称评定和绩效考核方法,鼓励医生开展和参与临床研究。职称评定方面:一方面临床研究在医生职业晋升评定中的比重较低(特别是专职临床研究医生的职称晋升方面未落地);另一方面职称评审权存在复杂性(不同地区分属在卫生健康委、医院、大学等),应推动充分考虑临床研究实际的考核标准优化。绩效考核方面:可更多将临床研究纳入所在医院科室和个人的绩效考评(如采取研究患者和普通患者的绩效权重差异化等)。
三级医院评审标准现行政策
现行政策
根据《三级医院评审标准(2020 年版)》[3]评定标准共3 个部分101 节,设置448 条标准和监测指标,4 条涉及临床研究,占比不足1%。
第一部分为前置要求部分。共设 3 节 25 条评审前置条款,不直接涉及临床研究。
第二部分为医疗服务能力与质量安全监测数据部分。共设74 节 240 条监测指标,其中2 条涉及临床研究。
第一章 资源配置与运行数据指标
五、科研指标
(一)新技术临床转化数量
(二)取得临床相关国家专利数量
第三部分为现场检查部分。共设 24 节 183条,其中2 条涉及临床研究。
第三章 医院管理
八、科研教学与图书管理
(一百七十六)有鼓励全员参与科研工作的制度和办法,促进科研成果向临床应用转化,并提供适当的经费、条件、设施和人员支持。
(一百七十七)开展药物、医疗器械临床试验以及研究者发起的临床研究应当符合《药物临床试验质量管理规范》《医疗器械临床试验质量管理规范》等相关规定。
调整建议
细化临床研究相关科研指标评定标准要求。例如,除新技术临床转化数量指标外,增设基于技术转化带来的实际临床价值的质量指标。除取得临床相关国家专利数量指标外,增设专利影响力相关指标。
细化鼓励全员参与科研工作的制度和办法。例如,对促进科研成果向临床应用转化的经费、条件、设施和人员支持提出具体指导建议。
适当增加临床研究相关评定标准数量。例如,在第三部分第二章第五节诊疗质量保障与持续改进中加入“临床研究管理与持续改进”相关内容。
加入对临床研究完成情况的跟踪监测标准。例如,在第二部分第一章资源配置与运行数据指标中加入“承担与完成临床试验项目/ 每百张开放床位”等临床研究完成情况监测指标。
医院绩效考核现行政策
现行政策
基于2019 年国务院办公厅《关于加强三级公立医院绩效考核工作的意见》[4],医院绩效考核现行指标体系包括四大方面:医疗质量、运营效率、持续发展、满意度评价,共计55 条,其中2 条涉及临床研究。
三、持续发展
(十一)学科建设
50. 每百名卫生技术人员科研项目经费
51. 每百名卫生技术人员科研成果转化金额
调整建议
增加临床试验完成量和水平相关指标。例如,在“三、持续发展”下,增设“医院临床试验完成情况”指标,具体指标可考虑包括“临床试验的项目数量/ 平均在职医师数或床位数”等;或在“(十一)学科建设”类别中,增设“医院高水平科研成果及临床重点学科建设”指标,具体指标可考虑包括“参与国际多中心临床试验数量”等。
增加临床研究效率相关指标。例如,在“二、运营效率”下,增设“临床试验成本效率” 指标。
2. 临床研究资源投入
国家自然科学基金、国家科技重大专项、国家重点研发计划、基地和人才专项等是我国现阶段医学研究发展的主要资金来源,但目前临床研究可以得到的支持有限。在2019 年度国家自然科学基金批准资助的医学科学部项目中,临床医学研究相关项目只有94 个,占比不到1.0% ;获批资助的总基金为4733.10 万元,占当年国家自然科学基金总额的0.2%,每项平均仅50 万元左右,同产业临床研究费用存在数量级的差距[5]。
可考虑增加临床医学研究在医学科学研究基金中的占比,并推动卫生健康委、科技部、医疗机构、高等院校等设立临床试验专项科研计划或科研基金,支持鼓励临床医生进行对口的临床医学研究。
三、临床能力建设:现状与未来展望
(一)临床人才培养
1. 学校教育
我国教育体系中对于临床研究人才的培养相对缺乏,尽管学校教育课程设置方面已有一些突破,包括新学科的设立(如临床研究方法学)和新课程的开设(如北京大学医学院2020 年春季学期首次开设的《临床研究项目管理》课程),未来可考虑拓展到其他课程和更多院校。
临床研究(方法)学是专门用于指导和开展临床研究的科学理论和方法,是在临床研究实践过程中,相关学科交叉融合,逐步形成的一门新的学科。北京大学临床研究方法学于2015 年招收首届研究生,作为临床医学一级学科下的二级学科。目前,北京大学临床研究方法学暂设以下6 个主要研究方向:①临床研究的伦理学实践;②临床研究项目开发与设计;③临床研究的数据技术与应用;④临床研究的统计设计与分析;⑤临床研究项目管理与质量控制;⑥新药与医疗器械临床研究法规与注册。
《临床研究项目管理》课程由北京大学临床研究所自2020 年起开设,该课程为临床研究方法学临床研究项目管理与质量控制专业的硕士研究生必修课,也可供其他与临床研究相关专业硕士、博士研究生选修,同时开放面向社会相关行业专业人员旁听。课程的设立旨在支持学生掌握临床研究项目管理与质量控制的基本理论知识和技能,了解国内临床研究需遵守的有关法律法规及伦理学要求等。该课程希望为学生的研究生课题实施与管理提供帮助,并且有助于学生了解由申办者和研究者发起的2 类临床研究在项目管理上的区别,提前思考未来的职业发展和就业方向。
临床人才培养的学校教育扩展可考虑临床研究护士课程。国际上临床研究护士已形成较为独立的工作范畴,其工作内容和工作任务明确,美国在2010 年成立了国际临床研究护理协会,为全球临床研究护理的发展提供交流平台。临床研究护士作为临床研究团队成员之一,担负着对患者或健康受试者临床研究的特殊护理工作。临床研究护士的必要性主要体现在2 个方面:①临床试验过程中护理工作不可或缺:临床试验是基于临床诊疗工作,受试者在试验中需要接受正规的医疗行为。在临床试验中,给药、注射、抽血等护理工作须由具备相应资质的专业护士进行。②专职研究护士在临床试验协调管理工作上具有独特优势:目前国内临床研究协调员缺口及流动十分巨大,专业水平和工作能力良莠不齐,专业的临床研究护士可不过分依赖临床研究协调员、独立完成本专业科室临床试验的协调工作,对临床研究的推进尤为关键。与此同时,临床研究护士对本专业科室的业务更加熟悉,可对临床试验协调管理工作起到进一步优化作用。除学校课程设置外,临床研究护士的职业发展路径与考核体系也需全面配套。包括在职称评定、继续教育、资格认证等方面提供机会,并打通相应晋升通道;保证临床研究护士的考核维度同其临床研究工作内容挂钩。
2. 职业教育
新药开发除了理论基础,还需要经验科学。因此需要在工作过程中系统的继续教育,成人教育和社会化培训的重要性不可忽略。全面推进职业教育,可考虑在行业协会的牵头下,整合监管机构、高校、药企申办方、合同研究组织的能力,基于护理学院或者职业学校,通过融入实际案例的中高端职业教育和资质认定等方式培养临床研究专才。另外,可以通过由行业中经验丰富专业性强的专家组成的讲师队伍,开设相关专业课程,作为监管或临床人才培养的推荐途径。并用课程结业证书作为承担任务和职业晋升的考虑因素,提升监管和临床队伍的专业水平。
临床研究作为多学科合作的交叉应用科学,随着科学技术的不断进步持续高速发展,需要来自不同专业背景的、具有独立思考和学习能力的多元人才。目前我国临床研究人才主要来自医学、药学、公共卫生等领域,背景相对单一。我国临床研究人才的未来发展可以积极借鉴国外临床研究人才丰富来源的经验,让更多其他领域的人才了解临床研究科学,拓宽人才来源背景,吸引更多不同背景的人才加入临床研究队伍。
(二)数字化管理和平台建设
数字化工具平台建设可在临床研究的多个方面对研究的质量和效率起到推动作用。毫无疑问的是,新冠肺炎疫情影响了全球临床试验的进展,但也进一步激发、加速了现有科技和解决方案在临床试验过程中的应用和使用。如在2020 年4 月国家药品监督管理局联合国家卫生健康委发布的GCP 中,首次正式鼓励申办方和合同研究组织用远程监查等方式进行临床试验,与时俱进地利用现代化工具助力临床试验的顺利进行。在疫情的持续影响下,临床研究数字化进程被加速,利用数据生成洞察,提升临床试验的效率并降低试验成本,成为行业的重要命题之一。
临床研究数字化工具平台的建设需推动完善药物临床试验项目及其机构备案信息系统建设,加强临床研究全过程的数据追踪和临床数据的全面数字化监督管理,围绕流程、模板、节点的指标管理形成评价体系,促进持续的质量改进。其建设同时可助力探索新技术在临床研究点选择、受试者入组、去中心化临床研究中心、远程监查等维度的无限潜力,最终有效实现在整个临床研究过程中提高效率、最小化风险、优化结果。
此外,还需要通过平台化建设提升数据的连通性,以提高数据收集的效率(如考虑利用医院现有的电子病历系统来收集受试者基本信息,而非在临床研究中重复采集)。
引用本文
中国医药创新促进会,中国外商投资企业协会药品研制和开发行业委员会.推进创新药同步研发、注册与审评,构建中国医药创新生态系统——临床研究高效性及临床能力建设[J].中国食品药品监管.2022.10(225):24-33.

来源:中国食品药品监管杂志


