导语
自从一百年前胰岛素被发现以来,科学家长期致力于寻求一种能够替代胰岛素的分子,想要以此制造出口服的胰岛素药物,从而取代注射胰岛素。WEHI研究团队的研究成果显著推进了胰岛素药物的开发。
澳大利亚WEHI医学研究所的研究人员对胰岛素替代分子模拟胰岛素作用的过程进行了可视化分析,研究证实,胰岛素替代分子可以激活胰岛素受体,促进葡萄糖吸收。这为开发替代1型糖尿病患者每日注射的胰岛素药物开辟了新的途径。
01、研究背景
制备口服胰岛素的阻碍主要是由于胰岛素是一种典型的蛋白质,而动物的消化道内充斥着胃蛋白酶、胰蛋白酶、蛋白水解酶等各种酶类。因此经口服的胰岛素会在消化道内被消化吸收,完全起不到降糖的作用。
“自发现胰岛素以来,开发胰岛素药丸一直是糖尿病研究人员的梦想,但经过几十年的努力,收效甚微,”Nicholas Kirk博士说。
随着冷冻电子显微镜(cryo EM)的发展,这项研究现在急剧加速。这种新技术可以在原子细节中可视化复杂的分子,快速生成胰岛素受体的3D图像。
Nicholas Kirk博士说:“通过冷冻电镜,我们现在可以直接比较包括胰岛素在内的不同分子如何改变胰岛素受体的形状。”
02、研究方法
在人体代谢方面,人胰岛素受体(hIR)在调节葡萄糖稳态方面起到关键作用。人胰岛素受体属于受体酪氨酸激酶类,其能够由胰岛素、类胰岛素一号生长因子(IGF-I)、类胰岛素二号生长因子(IGF-II)等激活。
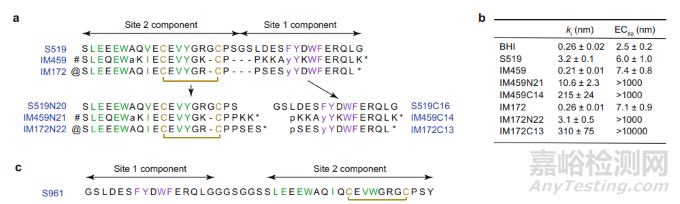
早期的研究者将胰岛素和胰岛素受体之间的结合进一步拆解成为蛋白质之间的相互作用,并且针对胰岛素受体表面的关键作用位点展开探索。其中,一种特殊的融合肽(同时具有 site 1 和 site 2 结构)被认为是 IR 激动剂。然而,由于缺乏对该类融合肽如何结合并激活 hIR 实际构象的了解,研究人员很难对这些肽家族展开进一步的开发工作。
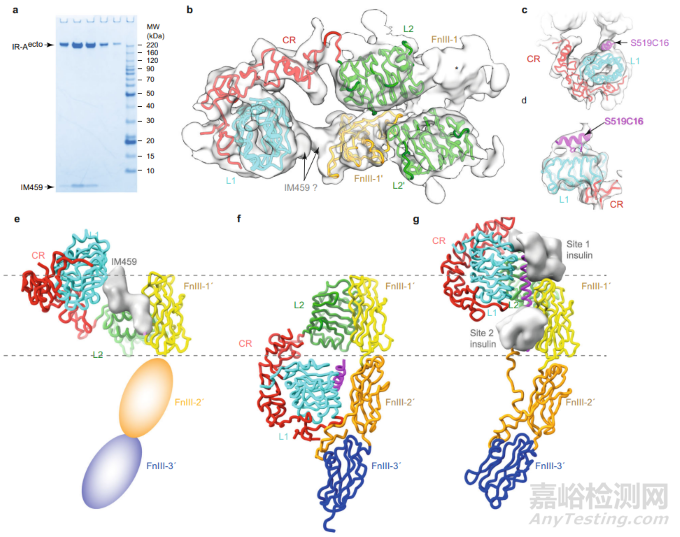
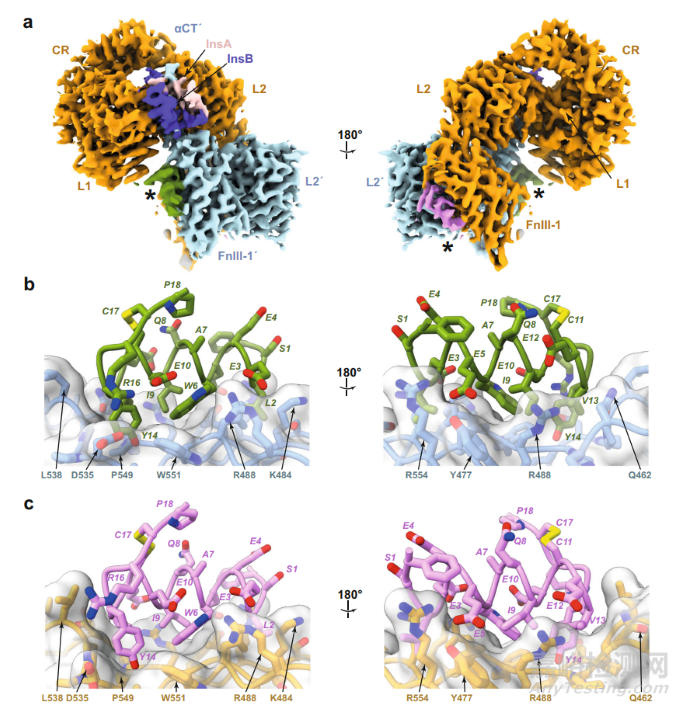
在本研究中,研究团队展示了两种 IR 激动剂,即 IM459 和 IM172 与胰岛素受体相互作用的高分辨率视图。基于单粒子冷冻电子显微镜图像表明,IM459 能够将 hIR 结构域 L1 与 hIR 结构域 FnIII-1' 交联,而 IM172 的 Site 2 组分(“IM172N22”)则能够与 hIR 胞外域复合。总之,这些数据阐明了开发可用于治疗糖尿病的新型 hIR 激动剂的途径。
03、研究结果
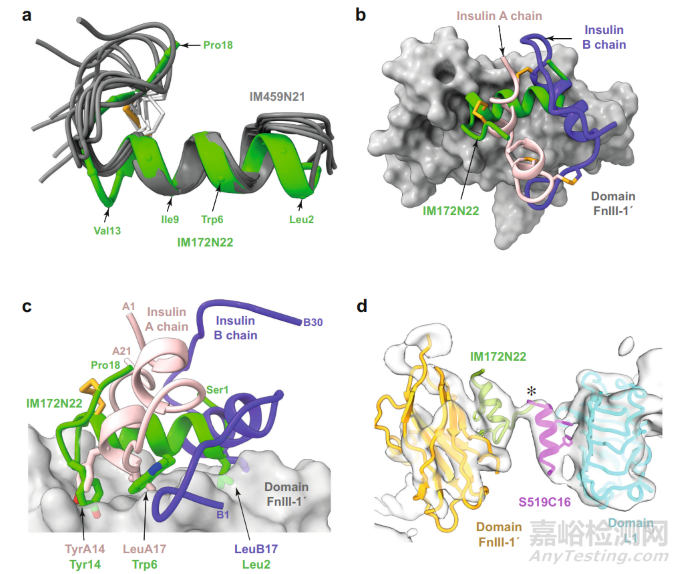
对于 IM172 而言,研究团队未能获得与其 site 2 结构 IM172N22 复合的 IR 胞外域图像。不过,在将 IM172N22 绑定到与胰岛素和单克隆抗体 83-7 的可变结构域进行预复合后发现,其与 IR 上多个位点发生相互作用,并且与结构域 FnIII-1 的相互作用十分稳定,其螺旋二级结构保持完整。
总体而言,这些分子能够与胰岛素受体相互作用,并将其保持在“活性”位置。
从生化角度来看,IM459 与 IM172 对于 hIR 的亲和力与生物合成的人胰岛素具有相当的水平,但它们的结构中包含能够降低蛋白水解敏感性的突变,这就使得其在稳定性方面具有优势。
“事实证明,胰岛素与受体之间的相互作用比人们预测的要复杂得多,胰岛素及其受体在合作时会发生巨大的形状变化。”Nicholas Kirk表示,“借助冷冻电镜,我们现在可以直接比较包括胰岛素在内的不同分子如何与胰岛素受体发生作用。”
尽管该项研究成果距离落地转化与治疗还很遥远,但其发现或将为 1 型糖尿病口服药物的研究打开大门,从而减少糖尿病患者对注射胰岛素的需求。