对于口服小分子药物,药物化学家的首要任务是提高其生物利用度(F%),以达到临床上可预测、稳健的暴露。通常影响F%的主要因素有肠上皮的渗透性、溶解度、溶解速率、首过代谢、胃肠道代谢以及化学降解等,其中肠上皮的渗透是影响F的关键因素。
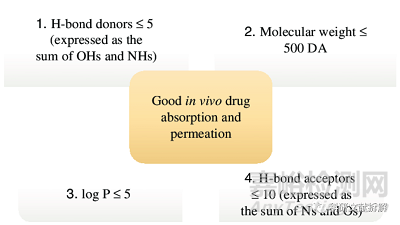
药物化学家通过调节化合物的类药性质来调控药物的代谢动力学,进而影响其口服生物利用度。药物类药性质和生物利用度之间的关系最早由经典的Lipinski的五原则(Ro5)来确立,后续不同头部公司都进行了扩展和衍生。随着药物性质的变化以及对药物和机体作用机理的理解,Ro5中一些的限定已经变得不那么重要了,比如Ro5中的分子量参数对于预测药物的溶解度和渗透性方面并没有LogD和芳环数更重要。
为了寻找最新的影响口服药物渗透和生物利用度的分子特性趋势,拜耳公司科学家从自己公司中挑出2000多种具有大鼠口服F%数据的化合物,以及20000多种具有Caco-2渗透性数据的化合物进行总结分析,以促进口服药物F%和渗透性的优化,特别是那些超越Ro5规则之外的(bRo5)化合物-比如大分子量的PROTAC-提供设计参考。
影响口服生物利用度的关键参数
总共筛选出2237个分子的大鼠口服生物利用度数据,关注溶解度、渗透性和肝脏代谢三种参数对生物利用度的影响。
溶解度在药物吸收中起到重要作用,因为药物分子必须先溶解之后才有可能被吸收,首先考察了动力学溶解度和F%的相关性,得到的结论是:没有相关性。
因为动力学溶解度只是热力学溶解度的近似值,而且早期在研究F%时,通常是使用溶解处方给药,导致溶解度的影响被大大降低。
Caco-2渗透性数据和肝细胞清除率和F%有着一定的相关性。渗透性增加,以及大鼠肝细胞稳定的化合物,F%通常较高。这表明肠渗透性和首过代谢对F%影响较大,同时如果其中一个参数(比如渗透性)很差,即使另一个参数(比如代谢稳定性)很好,也很难总体提高F。外排转运体对渗透性的影响包括在上述数据中(Papp A-B),通过对外排比的计算发现,外排比较低的分子F也较高。
肠道渗透性和外排是影响F%最关键的参数之一。在拜耳计划推进的口服PCC分子中没有一例是渗透性差的分子。
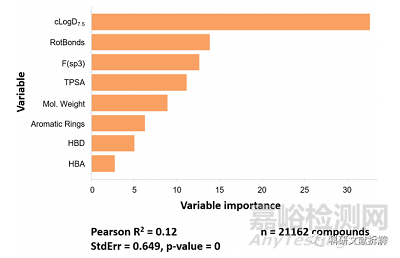
结构特性与肝脏代谢
肝脏代谢也是影响F的主要因素,在常用的分子特性中,亲脂性被认为是和肝脏代谢最相关的参数,分子的亲脂性强就会通过疏水相互作用和肝脏的代谢酶更强结合,代谢效率更高。其他相关的参数有可旋转键数(rotBonds),饱和碳占比(F(sp3)),拓扑极性表面积(TPSA)等也会不同程度影响肝脏代谢。
8种变量对化合物肝脏代谢的相对重要程度
不过需要注意的是这些参数并不是严格的完全独立,有些参数是相互关联的,比如饱和碳占比较高的分子通常亲脂性也较高。
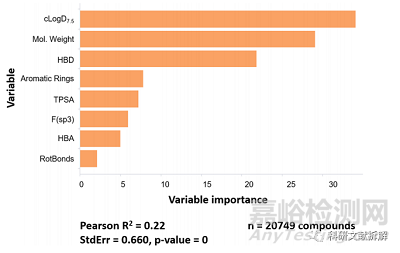
结构特性与渗透性
接下来从Caco-2实验中的渗透性数据分析影响渗透的因素,首先排除了回收率<65%的分子,一些分子的低溶解度可能是造成回收率较低的一个原因。
1:分子量、亲脂性对渗透性的影响
8种变量对化合物A-B方向表观渗透率的相对重要程度
将化合物分为低 (≤400)、中等 (400 < x ≤ 600) 和高 (x > 600) 分子量范围,从下图可以看出一个趋势,低分子量范围渗透性更好,在更低 (cLogD7.5 < 0.5) 和更高高亲脂性 (cLogD7.5 > 5) 的极端情况下,平均渗透率接近于零。不过在高亲脂性的条件下偶尔会出现一些高渗透分子的特例。
不同分子量级别都是在clogD7.5=3.25附近的化合物具有最佳的渗透性,和Ro5规则中类似。
右图中也显示,分子量较低的化合物外排比通常较低,不过随着分子量的趋势增加,出现最大外排比的LogD7.5值也相应增加,比如低分子量的最大外排比出现在1.25,高分子量化合物出现在2.25。因此设计分子时需要兼顾最佳渗透性和最小外排比之间的平衡。
在极端的高LogD的化合物如果想得到高渗透性,必须分子量较小;在LogD7.5=3.25的最优质值附近的化合物可以保持良好的渗透性,直到分子量大于700。
通常会有人疑惑,为什么更高的亲脂性化合物渗透性反而降低了?主要原因可能是高亲脂化合物和细胞膜中的脂质部分疏水结合力较强,无法穿透细胞膜进入水相,因此化合物亲脂性过高也会影响其渗透。
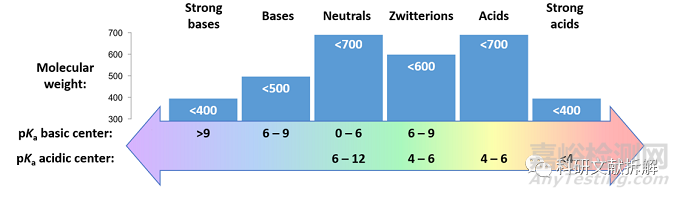
2:分子量、pKa对渗透性的影响
碱性化合物(pKa>6,在生理pH=7.4条件下部分或者全部电离)在分子量小于500时具有良好的渗透性,超过500,平均渗透性开始变差,不过即便分子量达到700,也会存在具有良好渗透性的碱性化合物。
更强碱性化合物(pKa=9-10)只有在分子量小于400才具有良好的平均渗透性,可能高分子量加上质子化后的电离状态对分子通过疏水膜难度更大。
非碱性化合物(pKa≤6)在分子量小于700的范围内均表现出中等至优良的渗透性,分子量也超过了Ro5规则中500分子量的限制。
强酸性化合物(pKa<4)和强碱性化合物类似,在分子量小于400时表现出良好的渗透性,也是由于其在生理环境的电离限制了其穿越膜的亲脂部分。
不过分子量、pKa和外排比之间的关系有些混乱,无法提供明显的趋势指导,因此通过设计分子的分子量和pKa可以调整其渗透性,但是无法克服外排比的问题(当然运气好的时候除外)。
总结出pKa、分子量具有良好渗透性的范围,上图为超过50%的化合物具有良好渗透性的pKa、分子量范围。
3:其他参数对渗透性的影响
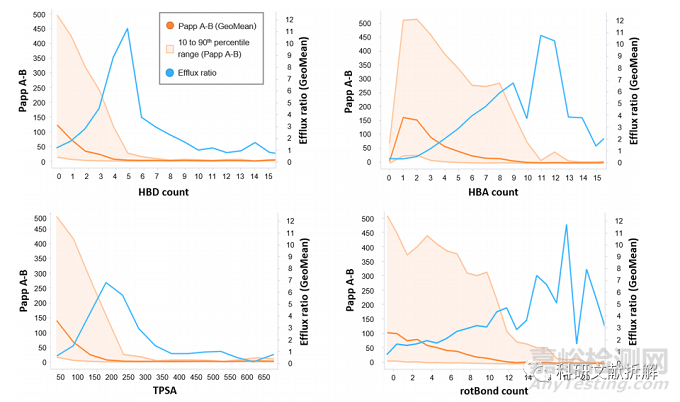
HBD(氢键供体)从0-5,平均渗透性逐渐降低,超过该范围,渗透性接近最小值;
HBA(氢键受体)从1-10,平均渗透性逐渐降低,超过该范围,渗透性接近最小值;
TPSA(拓扑极性表面积)从0-250,平均渗透性急剧下降,超过该范围,渗透性接近最小值;
可旋转键数增加,A-B渗透性逐渐降低,直到超过12-16旋转键,渗透性接近最小值;
芳环数目增加,A-B渗透性逐渐降低,直到7个芳环时,渗透性接近最小值;
F(SP3)饱和键占比对渗透性以及外排比没有明确的相关性。
对于以上几个参数,检测了B-A渗透性基本也符合上述趋势。
上述几个特性在外排比上却表现出相反的趋势:随着HBD/HBA/TPSA/可旋转键、芳环数的增加,外排比(蓝色线)也增加,不过在超过某一界限时,外排比会逐渐下降,比如HBD从0-5,外排比逐渐增加,在超过5时,外排比开始下降。
bRo5化合物的F%和渗透性
通过以上分析发现大多数情况都是符合Ro5范围,不过唯一例外的是分子量,Ro5的上限是500,但是对于很多分子-特别是中性分子,分子量扩展到700依旧存在很好的渗透性。
不过在分子量大于700后,大多数分子都表现出很低的渗透性,只有大约6%的高分子量分子表现出中高等渗透性。对于这些表现较好分子分析了其主要特性:
1:分子中含有大环结构:大环结构的折叠掩盖了分子表面的一些特性(比如裸露的极性基团)同时降低了其柔性,这些有助于其穿透细胞膜。
2:存在linker结构:linker如哑铃的连接臂,广泛应用于PROTAC中,设计良好的linker可以使大分子类似大环一样折叠,掩蔽极性基团和降低旋转。
这种在水和非极性环境中可以变换折叠构象的性质被称为变色龙效应,通过利用该性质可以提高大分子量分子的渗透性。
另外Abbive科学家建议使用AB-MPS来指导F%优化。
AB-MPS定义为违反>1项Ro5规则且分子量大于500。AB-MPS=(abs(cLogD7.4-3)+芳环数+可旋转键数),AB-MPS大于14在大鼠中表现出较差的F%。
总结优化F%和渗透性的准则
口服生物利用度主要取决于渗透性和代谢稳定性,优先从该两个参数优化提升F%。
当代谢稳定性较差时可以通过降低分子的亲脂性来获益,通过代谢物结构识别减少代谢软点。
动力学溶解度对优化F%的指导意义有限,有价值的是热力学溶解度,但是在前期很难获得热力学溶解度。
渗透性差的化合物影响最大的是LogD、分子量和HBD,将LogD7.5优化到3.25附近,同时尽量降低分子量和HBD。
此外,降低HBA、TPSA、可旋转键和芳环数也可以提高渗透性。饱和碳占比没有指导意义。
酸碱化合物将pKa优化到接近中性可以提高渗透性,不过如果是因为外排的原因导致渗透性变差,不建议继续将pKa优化到中性。
酸pKa>4;碱pKa<9;在分子量大于700的情况下有可能实现高渗透,pKa不在此范围需要降低分子量到500以下实现高渗透。两性离子,碱性中心的 pKa <9,酸性中心的 pKa >4,则高渗透性是可能的。
对于分子量大于700的化合物实现高渗透有很大难度,但是通过环化和形成分子内氢键可能有益,另外对于这类分子Caco2实验不能提供可靠的渗透性数据,需要通过EPSA(实验极性表面积)分析手段来实现。
参考文献:
Trends in Molecular Properties, Bioavailability, and Permeability across the Bayer Compound Collection
DOI:10.1021/acs.jmedchem.2c01577