近日,广东省药品监督管理局发布关于优化新版GB9706系列标准建议及审评审评有关工作的通知,内容如下:
各地级以上市市场监督管理局,省药品监管局各有关直属事业单位,各有关单位:
为稳步推进GB 9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》及配套并列标准、专用标准(下称新版标准)实施,贯彻“放管服”改革精神,现就我省第二类医疗器械延续、变更注册事项执行新版标准有关事宜通知如下。
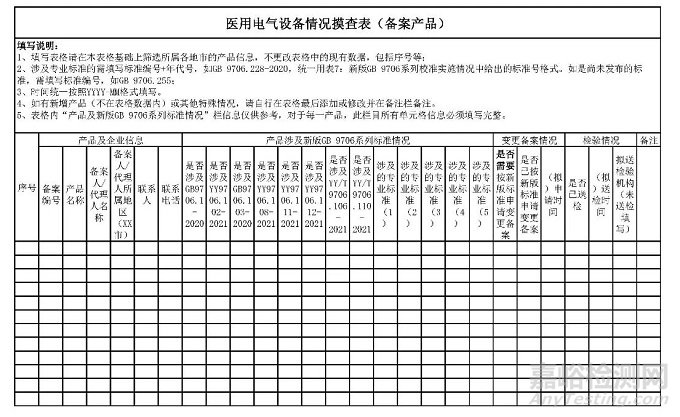
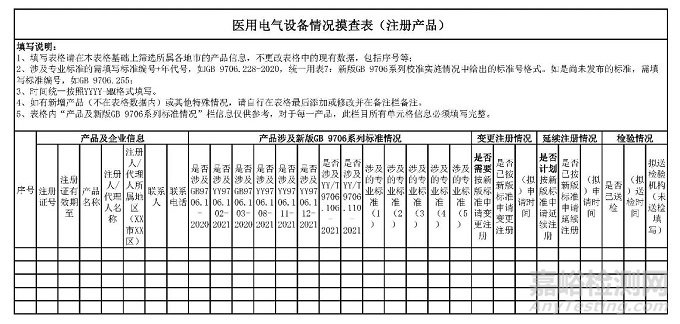
一、开展标准执行情况摸查。各市局落实属地监管职责,按照省药品监管局下发的辖区内已获准注册产品清单,组织对辖区内产品的标准适用情况,以及检验、注册或备案进展及计划进行全面摸查,填写《医用电气设备情况摸查表》(见附件1),并于4月10日前反馈至省药品监管局行政许可处。
二、并联开展延续与变更注册。延续注册时,申请人为满足强制性新版标准要求,在产品未发生变化的情况下,可以同时提出变更产品技术要求。申请人应当提供相关声明,并详细列明新旧产品技术要求内容变更的对比表。有关办理时限按照变更注册要求执行。
三、实施审检联动。申请人在提交注册申请时,除未完成检验外,其他符合受理条件的,可提交符合新版标准的书面承诺(见附件2)进行受理。受理后实行审检联动、边审边检,在补正资料时限内补充完整的产品检验报告。
检验报告类型为自检报告或委托检验报告的,审评中根据需要告知补正部分或全部项目的检验内容。按照免征类型申请注册检验的,应凭注册受理通知书向相应检验机构申请。
注册检验结论不合格的,必要时开展注册质量管理体系核查,核查不通过的,按不予注册处理。
四、其他要求
(一)各市局组织做好辖区内企业的全覆盖培训,督促企业对照新版标准要求,充分开展产品验证工作,确保送检样品合格。
(二)对同一注册单元内包含多个型号的,注册申请人需提供典型产品的选择说明,所检验型号产品需是同一注册单元内能够代表其他型号产品安全性和有效性的典型产品,否则还应选择其他型号进行差异性检验。
本项工作自通知印发之日起试行,试行期至2023年12月31日止。试行期间如国家另有规定,按其规定执行。各相关单位工作中如遇问题,请及时向省药品监管局行政许可处反映。联系人及联系电话:田小俊、易准,020-37886591、37885802。
广东省药品监督管理局办公室
2023年3月24日
附件1.医用电气设备情况摸查表
附件2. 承诺书
承诺书
本公司(单位)申请办理 (产品名称)第二类医疗器械注册证 事项。现就相关事宜作出如下承诺:
一、已经知晓《广东省药品监督管理局关于优化新版GB 9706系列标准检验及审评审批有关工作的通知》的全部内容;
二、产品符合新版GB 9706系列标准要求;
三、在补正资料时限内补充完整的产品检验报告(□自检报告 □委托检验报告 □免征类型注册检验报告);
四、在未能取得正式批准文件之前,承诺不开展相关生产活动;
五、所作承诺是真实意思表示,提供的所有申请材料真实有效,愿意承担失信产生的后果。
承诺单位(盖章):
法定代表人(签字):
年 月 日





