您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-04-08 08:13
摘 要 / Abstract
目的:《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》提出“加快建设数字经济、数字社会、数字政府”。研究药品安全风险预警大数据决策体系,具有提升监管的预见性、靶向性、时效性,是实现药品全生命周期风险管理的支撑条件。方法:采用霍尔三维空间结构系统工程方法分析药品安全风险预警大数据决策体系的数据框架,采用层次分析法(AHP)分析药品安全风险预警大数据决策体系的模型设计准则。结果:基于药品监管系统内外大数据应用现状、八个维度药品监管数据的风险特征和大数据决策模式分析等,AHP评价结果显示“研判发现药品安全系统性风险”“及时消除区域性重大药品安全事件”“构建药品监管质量管理规范(GRP)”三者权重分别为23.21%、22.72%和54.07%,GRP是最为关注方案。结论:模型设计准则对药品安全风险预警大数据决策体系具有理论指导意义。药品安全风险预警大数据决策体系建设的路径,包括应用价值、溯源生成、数据共建共享和推进监管方式转变等方面。
Objective:Outline of the 14th Five-Year Plan for National Economic and Social Development and Vision 2035 of the People’s Republic of China advocates to accelerate the construction of the digital economy,digital society,and digital government.Research on the big data decision-making system for drug risk warning can improve the predictability,targeting,and timeliness of supervision,which is a supporting condition for realizing the life cycle risk management of drugs.Methods:System engineering method of Three-Dimensional Structure of A.D.Hall and Analytic Hierarchy Process (AHP) method are used to analyze the data frame and model design guideline of big data decision-making system for drug risk warning,respectively.Results:Based on the status quo of big data application inside and outside drug regulatory system,the risk feature of drug regulatory data from eight dimensions,and the analysis of big data decision-making models,etc.,the result,evaluated by Analytic Hierarchy Process (AHP) method,shows that the weights of "research and judgment of drug systemic risk","timely elimination of regional major drug safety incidents",and "the construction of Good Regulatory Practice (GRP)" are 23.21%,22.72% and 54.07%,respectively,and GRP is the most concerned solution.Conclusion:The model design criteria have a theoretical instructive significance for the big data decision-making system of drug risk warning,whose building path includes the application value,traceability generation,data co-construction & sharing,the promotion of transformation on the supervision method,and so on.
关 键 词 / Key words
药品;风险预警;大数据;决策
drug; risk warning; big data; decision-making
《药品管理法》确立 “风险管理、全程管控、社会共治”的原则,明确 “国家建立健全药品追溯制度”和“国家建立药物警戒制度”,对推进药品风险管理大数据体系建立具有重要引导作用。药品安全风险预警大数据决策体系具备发挥药品监管科技中数据要素的转型升级作用,也具有促使药物警戒溯源生成,推进药品安全追溯管理体系建立的积极意义,同时,还能助力践行《国家药监局关于药品信息化追溯体系建设的指导意见》和《国家药品监督管理局关于加快推进药品智慧监管的行动计划》的相关要求。美国食品药品监督管理局(FDA)于2021年3月发布《数据现代化行动计划》(DMAP),提出药品监管科学的基础可能来自相对传统的数据来源,例如临床试验资料和现场检查数据。当前,我国药品安全数据要素分散于药品监管部门和其他相关职能部门、企业和移动互联等,因此,有必要利用现有药品监管数据资源,促进传统监管方式转变为“智能监管”和“数字监管”,构建药品安全风险管理大数据决策体系。
01 药品安全风险预警大数据决策应用现状
1.1 药品监管系统的药品安全大数据应用现状
当前,我国对于药品安全监管力度不断加强,监管精准性和时效性的要求也越来越高,但是违规行为和手段越来越隐蔽已成为药品安全监管工作面临的新问题;同时,监管人员面临着任务多、压力大、人手少、要求高等问题。如何解决监管能力和监管任务之间资源配置不充分、不均衡的问题,需要大数据决策的制度创新。但是,现有的管理体系与大数据背景存在一定的不适应性,监管部门的大数据处理能力尚存在进步空间;受托的软件公司采用的大数据技术极易产生其使用监管数据信息的随意性[1]。药品监管信息化工作长期以来对商业流程和数据挖掘的理解仍存在不足,亟需药品安全大数据决策体系理论和知识体系给予指导。
经过多年的药品安全信息化发展,我国大部分地方政府已经搭建完成了行政审评类、日常监管类、业务监控类和综合应用类等多种信息化应用系统。但目前地方政府药品安全监管数据总体上仍呈现散在的、不对接和不成体系的状态。地方药品安全数据信息可分为动态信息和静态数据,根据这些数据特点和特征,有必要采用大数据挖掘方法和工具,探索提升药品监管效率、效能和效果的风险评估模式,促进药品安全监管方式的转型和升级。面对大数据时代的机遇,传统的药品监管方式应向大数据决策转型发展,并实时将药品监管系统内的监管数据与外部数据共享衔接、分析处理,可辅助于管理决策、扩大数据应用范围、进行药品安全监管制度创新、提升监管工作的有效性和精准性[2]。
1.2 药品监管系统外围大数据应用现状
根据《药品管理法》以“保障公众用药安全”为立法宗旨,有必要利用真实世界证据(RWE)、追溯管理体系和智慧监管的实施契机,推进药物警戒数据链建设进程、评价药物安全性和保障用药安全。根据当前我国非诉讼纠纷解决程序(ADR)机构设置和制度安排,药物警戒数据信息主要来源于医疗机构的个例安全性报告(ICSR)和药品上市许可持有人(MAH)定期安全性更新报告(PSUR),尚未与卫生信息系统(HIS)、医疗保险数据、药品监管数据、疾病预防控制中心(CDC)免疫规划疫苗、特药印鉴卡数据等衔接。再者,药品投诉举报数据信息药品监管部门不能实时掌握,日常检查文本数据利用程度相对不足,以及抽检数据仍需要与ADR数据形成序贯式大数据决策支持体系。2020年1月国家药品监督管理局发布《真实世界证据支持药物研发与审评的指导原则(试行)》,提到真实世界数据(RWD)的潜在来源,包括但不限于HIS、医保系统、疾病登记系统、国家药品不良反应监测哨点联盟等。
药物警戒RWD框架中组织结构不仅涉及多个部门和单位,还包含了种养殖、研发、生产、流通和使用等方面的药物警戒信息数据源。王涛等[3]提出药物警戒体系框架的法规体系、组织体系、技术体系三个核心组成要素。基于我国药物警戒制度建设初期的数据挖掘现状和特点,本文采用霍尔三维空间结构系统方法分析评估药物警戒制度信息机制的RWD框架,包括分类分级监测、监测组织结构、RWE三维数据结构,以及与ADR数据报告(ICSR、PSUR)等相结合的分布式记账本式的数据结构框架,以明晰药品安全风险预警大数据决策体系的建设思路与方法(图1)。
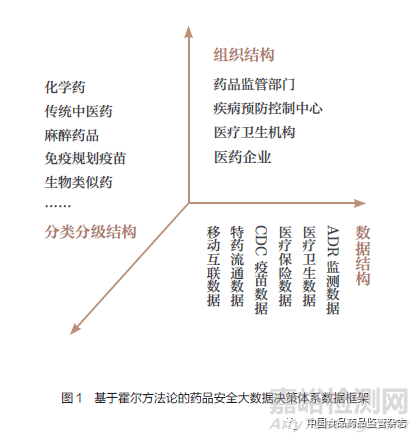
02 药品安全多维度数据的风险点和风险特征
2.1 风险管理的数据管理模型和评估技术
《风险管理 术语》(GB/T 23694-2013)明确“风险管理(risk management)是在不确定性对目标的影晌方面,指导和控制组织的协调活动”;《风险管理 原则与实施指南》(GB/T 24353-2009)提出“任何类型和规模的组织都面临风险,组织的所有活动也都涉及风险”,“风险管理通过考虑不确定性及其对目标的影响,采取相应的措施,为组织的运营和决策及有效应对各类突发事件提供支持”。风险管理过程由环境信息、风险评估、风险应对、监督和检查的活动组成;风险评估包括风险识别、风险分析和风险评价的全过程。沟通和记录,贯穿于风险管理的各项活动中。根据《风险管理 术语》和《风险管理 原则与实施指南》技术规范,确立药品安全风险管理模型(图2),为药品安全风险评估大数据决策体系建设提供理论基础。
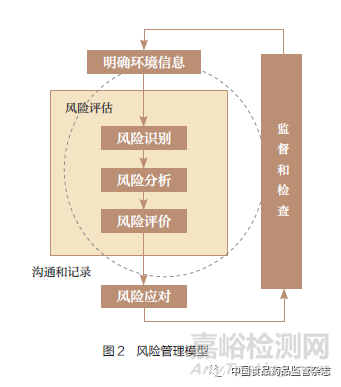
《风险管理 风险评估技术》(GB/T 27921-2011)中的风险评估技术,是药品安全风险评估大数据决策体系中风险指标设计的基础工具,“选择合适的风险评估技术和方法,有助于组织及时高效地获取准确的评估结果”。在具体实践中,风险评估情况千差万别,并且其形式及结果应与组织的自身情况相适合。选择合适的风险评估技术和方法,有助于监管部门、企业或社会组织及时高效地获取准确的评估结果。
2.2 八个维度数据的风险点和风险特征
当前,我国药品监管业务流程中已具备了日常检查、抽检工作、ADR监测、药品召回、网络药品检测、舆情监测、投诉举报、案件查办等八个维度的数据,其风险点和风险特征有所不同。近年来,国家药品监管部门每年都组织编写《药品审评报告》《药品检查报告》《案件查处分析报告》《国家药品抽检质量状况报告》等分析报告[4],但仍不能满足国家和地方药品安全风险预警决策和药物警戒体系建设的现实需要。以药物警戒体系建设作为风险预警大数据决策的目标,整合药品安全各环节数据,构建药品安全风险预警大数据决策体系模型。药品监管业务中八个维度数据的风险特征有所不同,有的数据信息更多适用于药品安全系统性风险的研判,有的偏向于重大药品安全事件的处置和应对,有的数据是促进药品监管质量管理规范(GRP)制度的建立,以降低监管成本和提高监管绩效。
①药品检查数据。《2017年度药品检查报告》数据显示:批准上市前药品GMP符合性问题较多,说明企业在药品研发过程中质量管理体系建设比较薄弱,对药品GMP 的符合性关注不够;存在研发过程中生产质量管理规范执行不足、偏差及超标调查不充分、工艺验证不科学等问题。②案件查处数据。《全国药品违法案件查处情况分析报告》(2019)数据显示:案件查处内容包括案件来源、地域分布、数量变化、案件查处等。药品违法案件,一是来源于日常监管和专项检查;二是来源于抽检监测;三是来源于投诉举报;四是来源于执法检查;五是来源于其他部门通报,以及来源于媒体曝光、上级交办等途径。③药品抽检数据。《2017年国家药品抽检药品质量状况分析报告》数据显示:抽检不合格产品数据分析中包括品种分类、检验项目和抽检环节等维度;抽检针对性遴选重点选择使用范围广、用量大、ADR较集中或投诉举报较多的品种;重点抽查质量标准等有重大提升后亟需进行质量评价的品种;重点对既往发现存在严重质量问题的品种进行跟踪抽检等。④药品审评数据。《2017年度药品审评报告》信息系统显示:其字段分析了药品申请审评完成情况、注册审评类别情况、创新药适应症分布情况和审评审批用时变化情况等;将药物临床试验审评质量体系的现场检查与药品审评数据的分析相结合,更进一步发现药品安全系统性风险。⑤ADR监测数据。《国家药品不良反应监测年度报告(2019年)》数据显示,通过对患者情况、累及器官系统情况和药品类别情况等数据统计,以及新的和严重药品不良反应/事件报告情况,均可以及时发现药品安全系统性风险和重大药品安全风险事件。⑥其他相关数据。药品安全大数据的内容,仍应具有相应的投诉举报、舆情监测、企业自检自查和追溯管理数据;投诉举报数据信息也反映了药品安全市民满意度和获得感,以及反映了地方药品监管和(或)药品安全总体情况;舆情监测借助网络平台,例如微博、微信、网络直播或小视频等,产生药品安全事件的传播或发酵等。
2.3 基于医药产品的风险特征
《药品管理法》明确了“及时发现药品安全系统性风险”,“及时消除监督管理区域内药品安全隐患”,“重大药品安全事件”,“对短缺药品实行预警”等规定。从地方政府属地监管责任落实情况来看,药品安全系统性风险、重大药品安全事件和GRP将成为国家和地方政府落实“四个最严”、构建和设计药品安全风险预警大数据决策的基本出发点。目前,地方监管部门对药品安全风险的严重性尚未进行具体的描述,仍缺乏量化指标和科学评价方法,涉及范围简单的按照1个、2个及以上市级行政区域划分,难以体现药品安全风险评估的科学性[5]。因此,各级药品监管部门都应从多维度认识药品安全大数据决策多维度数据,对医药产品、质量体系的风险特征以及地域因素,在药品信息化追溯体系、短缺药品清单管理制度、系统性风险、GRP等实施多维度数据挖掘,形成适合研判药品安全系统性风险、及时消除重大药品安全事件和构建GRP等设计目标下的药品安全风险预警大数据决策体系。
疫苗作为特殊的医药产品,其风险特征具有一定的典型性。近年来,我国疫苗领域不断突破,体系建设不断完善,但还存在部分疫苗企业为追求低价中标,压低生产成本,擅自改变生产工艺,成为疫苗产生质量和安全问题的隐患。依据《疫苗管理法》规定“疫苗流通”“预防接种”“异常反应监测和处理”是由国务院卫生健康主管部门牵头管理,MAH制定并实施疫苗上市后风险管理计划,形成了当前我国疫苗风险控制模式。
03 药品安全风险预警大数据决策模式分析
3.1 大数据决策模式概述
基于国内药品安全形势和资源配置现状,推进监管方式转变的政策要求,迫切需要探索和研究药品监管科学理论与方法。国内学者[6-8]从不同角度诠释了监管科学的内涵,毛振宾等[9]提出药品监管科学的学科体系和话语体系。美国FDA于2013年发布《推动药品监管科学的战略和实施规划》(Strategy and ImplementationPlan for Advancing Regulatory Science forMedical Products),提出药品监管科学的相关知识、方法、标准和工具。2020年3月欧洲药品管理局(EMA)发布《监管科学2025:战略思考》(Regulatory Science to 2025:Strategic reflection),提出监管科学为药品全生命周期内管理决策提供信息,包括生物医学和社会科学,旨在开发监管标准和工具。
《信息技术 大数据 术语》(GB/T 35295-2017)提出大数据(big data)是具有体量巨大、来源多样、生成极快、且多变等特征。依据《信息技术 大数据 数据分类指南》(GB/T 38667-2020),大数据分类是根据大数据的属性或特征,将其按一定的原则和方法进行区分和归类,并建立起一定的分类体系和排列顺序的过程。大数据分类过程划分为分类规划、分类准备、分类实施、结果评估、维护改进5个阶段。药品安全风险大数据包括药品监管系统内的监管业务数据之外,也包括医疗卫生、疾控中心数据、特药印鉴卡和移动互联数据等药品监管系统外数据。因而,将这些统计报告有机结合、统一决策,能够有效及时研判药品安全系统性风险、应对处置重大药品安全事件和构建GRP体系。
3.2 数据流管理分析
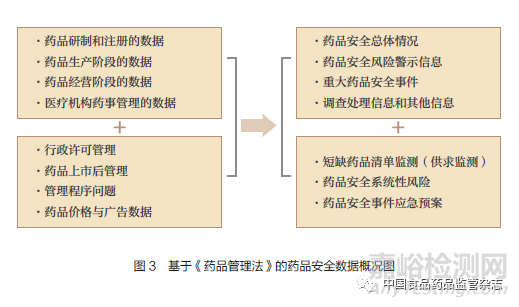
《药品管理法》确立“风险管理、全程管控、社会共治”原则,并明确了药品研制和注册、生产、经营、医疗机构的数据,以及许可管理、上市后管理、业务程序、价格和广告等数据,本文以短缺药品监测、系统性风险和药品安全事件应急预案为数据输出内容,概括了药品安全数据框架的结构,同时也包括药品安全总体情况、风险警示信息等,见图3。2019年5月《国家药品监督管理局关于加快推进药品智慧监管的行动计划》提出构建“大系统、大平台、大数据”,“建设完善覆盖本行政区域内的行政审批、监督检查、检验监测、风险分析等业务系统”。因而,笔者认为药品安全大数据决策体系已具备了良好的数据管理政策制度环境。
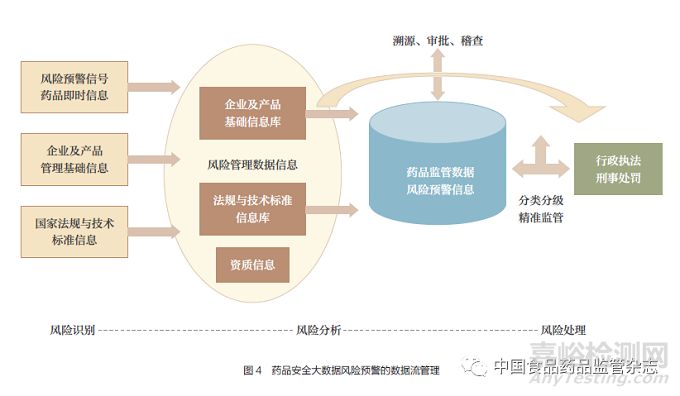
国家和地方药品安全监督管理的制度创新,是对药品安全监管业务流程再造的深化。本文基于药品安全风险评估大数据决策体系的数据源,构建和设计了药品安全风险评估模型构建中的数据流管理模型,见图4,进而构建药品安全风险预警大数据决策指标体系,为监管科学数据决策的发展策略设计提供理论依据。
3.3 大数据模式分析
依据《药品管理法》等相关规定和药品监管业务数据现状,本文设计和构建药品安全风险预警大数据决策模式的层析分析框架。
目标层:药品安全风险预警大数据决策。
准则层:药品安全系统性风险、重大药品安全事件应急、药品监管质量管理规范建设等。
方案层(数据指标):日常检查、抽检工作、ADR监测、药品召回、网络药品检测、舆情监测、投诉举报、案件查办、审评审批等数据。
基于药品监管系统内数据现状和特征,本文采用层次分析法(AHP)对药品安全风险预警大数据决策体系进行分析,以获得药品监管九大维度数据对药品安全风险预警的贡献率,见图5。
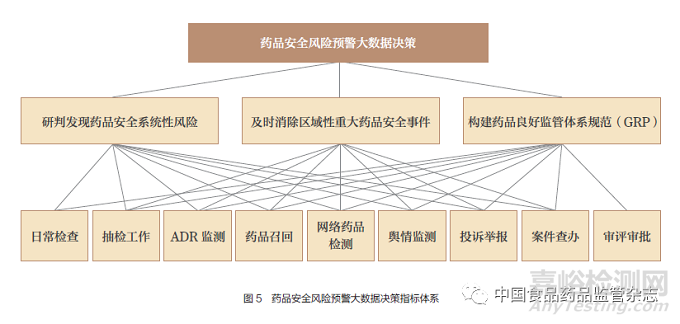
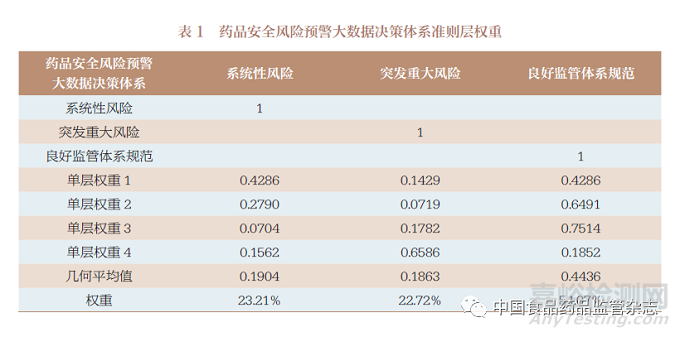
基于药品安全风险预警大数据决策体系调查数据,首先对准则层方案进行AHP分析,并进行一致性指标CI检验,再进行几何平均值计算,获得系统性风险、突发重大安全风险和良好监管体系规范的权重。结果显示:三者权重分别为23.21%、22.72%和54.07%,即良好监管体系规范是风险预警大数据决策体系的关键,见表1。基于对药品安全风险预警大数据决策体系的分析可以看出,分析和设计药品风险预警大数据决策体系模型,可以提升药品监管精准化、智慧化水平,为构建药品安全风险预警大数据体系应用示范提供参考依据。
3.4 方法学分析
基于药品监管部门信息系统和业务流程的实际情况,笔者认为药品监管数据更多包含了医药企业和(或)医药产品的行政许可、注册审评、检查和检验等数据。作为药品监管业务工作,监管部门更多情况下要做出行政判别和决策,即是管理决策技术运用的问题。2009年7月IBM公司收购SPSS并推出跨行业数据挖掘标准流程(Cross Industry Standard Process-Data Mining,CRISP-DM)数据开发标准,包括业务理解、数据理解、数据准备等6个步骤,以实现数据增值服务。因此,药品安全风险预警大数据决策方法工具,应包括聚类分析、管理决策技术、神经网络技术等。
3.4.1 常规的聚类分析和相关性分析
聚类分析和相关性分析,是大数据决策下的数据挖掘方法中最为常见的分析方法。聚类分析指将网络环境事物标签化处理,进行对抽象对象的集合分组为由类似的对象组成的多个类的分析过程。相关性是将事物相关特征进行分析,探索事物之间的关联程度。另外,文本数据的分类、整理、过滤、查询和分析,也是药品安全大数据决策体系数据源扩展的有效技术方法,可用于监管对象的“画像”特征描述。
3.4.2 神经网络技术的应用
由于大数据环境,必然导致数据集成冗余度大、数据描述不统一、数据表达准确性差等问题的出现,因而,需要利用贝叶斯网络、人工智能(AI)等方法进行梳理和判断数据的真实性和可靠性。基于当前大数据决策中的深度神经网络模型的复杂设计以及标签化训练数据的不足,建议采用基于神经网络的大数据决策及多种决策技术的综合应用。
3.4.3 决策技术工具的应用
大数据决策下的数据挖掘方法,还包括管理决策技术的决策树、灰色关联度法、层次分析法、模糊综合评价法等多种决策方法,均可用于药品监管目标的决策分析。
04 药品安全风险预警大数据决策体系建设的政策性建议
4.1 风险预警大数据决策体系的应用价值
《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》明确“加快建设数字经济、数字社会、数字政府,以数字化转型整体驱动生产方式、生活方式和治理方式变革”。本文基于药品安全风预警监测指标体系的研究基础,对药品安全风险评估大数据决策体系的应用价值进行评估分析,以及与行业产业“共建共享”的大数据价值共同分析,使其更贴近药品监管部门决策支持的真实需求,真正做到为提升药品监管的精准化和信息化水平提供决策参考。药品安全风险预警大数据决策体系的应用价值评估,从药品安全风险预警的研判、重许可轻监管的方式的转变、降低监管成本、提升监管绩效和药品安全属地责任考评的几方面来看,其有效发挥了数据要素的积极作用,能够满足追溯管理、药物警戒、绩效考核和政企共享等大数据决策的需求,推进监管方式转变、减低监管成本、属地责任落实和风险预警研判等监管目标的实现。
4.2 数据要素作用推进药物警戒溯源生成
传统要素与数据要素的融合,是建设高标准市场体系的关键步骤,传统要素与数据要素相互作用,能够有利于优化配置传统要素,有利于加快数字经济时代高标准市场体系的建立[10]。药物警戒的本质是风险预警大数据决策,大数据决策的目的是生成药物警戒溯源和推进追溯管理体系建设。通过药品安全风险预警大数据体系建设,以监管数据要素作用推进药物警戒溯源生成,一方面可以推进国家追溯管理体系建设进程,二是可以促进风险共治平台与药品追溯管理协同平台、监管数据共享平台的融合和设计。药物警戒数据服务领域,包括药物警戒第三方机构、药品记录数据管理服务第三方机构和追溯管理信息服务的第三方机构等,将这些相关数据进行整合,有助于药物警戒与相关数据信息服务平台的融合协同,推进药品安全风险共建共享平台的建设。
4.3 药品安全风险预警大数据共建共享路径
随着2018年《国家药品监督管理局关于药品上市许可持有人直接报告不良反应事宜的公告》的发布和2019年持有人(MAH)直接报告药品不良反应监测系统的建立,药物警戒第三方机构逐步进入药物警戒领域;《药物警戒质量管理规范》正式实施,充分落实药物警戒的MAH主体责任,药物警戒制度也将逐步成为GRP的重要组成部分。除了药品上市前(注册审评和临床试验)第三方机构进入药物警戒数据服务领域之外,药品生产经营记录与数据管理的第三方机构也开始进入药品安全风险预警大数据领域。2020年发布的《药品记录与数据管理要求(试行)》,对检验检测数据、生产经营行为活动数据和非结构化数据实施有效规范,同时推进了药品生产经营记录和数据管理第三方机构进入该领域,以构建药品安全大数据决策模型共建共治局面。
4.4 药品安全大数据体系推进监管方式转变
在大数据时代,大数据被看作是观察人们行为的“显微镜”和“仪表盘”[11]。药品安全风险预警的大数据决策体系,是提升药品监管精准化、智慧化水平有效途径。基于监管机构改革和职能转变进程所带来的监管体制纵向一体化和横向一体化的新变化,药品安全风险预警大数据决策体系应用场景和“数字监管”示范应用,将有效降低监管成本和满足监管风险偏好的需求。风险预警的大数据决策模型构建,是推进传统药品安全监管方式,向信用监管和“双随机、一公开”的事中事后监管模式转变的有效路径和方法。网络舆情、投诉举报与监督检查、稽查办案、检验监测等全部合并为药品监管发现机制。以往监管部门的数据信息是静态的、概况的,不能反映和综合药品生产经营产业现状,只有将监管部门基层日常监管信息的标签化、编码化处理,并与第三方机构专业化服务信息和投诉举报、网络预警等反馈信息,以及日常监管、监督型抽检和药物警戒三者数据有效的综合集成,形成有效的风险预警行政许可前置数据信息、重点监控事中信息和事后处置信息,才能为药品监管部门提供风险预警大数据决策的监管方案,促进基于风险预警大数据决策体系的药品安全监管方式的转变。
05 结 语
基于《药品管理法》确立“风险管理、全程管控、社会共治”原则和《国家药品监督管理局关于加快推进药品智慧监管的行动计划》提出构建监管“大系统、大平台、大数据”的政策目标,构建而成的药品安全风险预警大数据决策体系具有重要意义。药品安全大数据决策体系,是提升监管的预见性、靶向性、时效性基础条件,也是实现药品全生命周期风险管理的支撑条件。药品安全风险预警大数据决策体系,通过充分发挥数据要素在药品监管流程中重要作用,以提升“研判发现药品安全系统性风险”“及时消除区域性重大药品安全事件”和“构建药品监管质量管理规范(GRP)”药品监管工作决策的精准性和有效性。

来源:中国食品药品监管杂志


