今日头条
上海莱馥干细胞疗法获批ILD临床。上海莱馥生命旗下子公司提交的“人脐带间充质干细胞注射液”IND申请获国家药监局默示许可,针对的适应症为间质性肺病(ILD)。间充质干细胞具有归巢、多能分化的潜质,还能通过旁分泌和免疫调节作用,将其分泌的多种生物活性因子,改善炎症细胞局部浸润,防止邻近细胞凋亡和诱导细胞增殖,促进受损组织修复和再生。该新药此前已获批开展治疗特发性肺纤维化(IPF)的临床试验。
国内药讯
1.微芯PPAR激动剂新适应症报产。微芯生物PPAR激动剂西格列他钠片的新适应症上市申请获CDE受理,推测此次申报的新适应症为联合二甲双胍治疗经二甲双胍单药控制不佳的2型糖尿病(T2DM)患者。西格列他钠是微芯生物自主研发的全新机制降糖药,也是全球首款获批治疗2型糖尿病的PPAR全激动剂,此前已获CDE批准用于单药改善成人2型糖尿病患者的血糖控制。
2.勃林格殷格翰IL-36R单抗拟纳入优先审评。勃林格殷格翰佩索利单抗注射液(皮下注射)(spesolimab,圣利卓)上市申请获CDE拟纳入优先审评,用于预防泛发性脓疱型银屑病(GPP)发作。spesolimab是一款靶向IL-36R抗体药物,其静脉注射液已在中国获批用于治疗GPP发作。与静脉注射治疗相比,皮下注射剂型使用更方便,患者可自行给药,有望提高用药依从性。
3.复诺健溶瘤病毒获FDA快速通道资格。复诺健生物重组单纯疱疹溶瘤病毒产品VG161获FDA授予快速通道资格,用于治疗晚期肝细胞癌经治患者。它同时携带IL12、IL15/15RA(IL15和IL15受体α亚基)和PD-L1阻断肽(PDL1B)的基因,是全球首个携带四个免疫调控因子的溶瘤病毒产品,具有溶瘤活性与免疫刺激的协同抗肿瘤潜力。今年2月,FDA已授予VG161孤儿药资格,用于治疗肝内胆管癌(ICC)。
4.天辰创新IgE抗体早期临床积极。天辰生物全新一代抗IgE抗体LP-003将在2023年欧洲鼻科学大会/国际鼻过敏和感染大会/世界鼻科学大会上公布针对过敏性鼻炎适应症的I期临床积极结果。在PK研究中,1.0mg/kg、3.0mg/kg、6.0mg/kg、10.0mg/kg等剂量组的半衰期分别约为44.6天、65.2天、76.5天和75.6天;在PD研究中,3.0mg/kg及以上剂量组对受试者体内IgE的抑制时间长达168天以上;临床中未观察到3级及以上不良反应事件的发生。
5.葛兰素史克RSV疫苗中国获批临床。葛兰素史克「重组呼吸道合胞病毒(RSV)疫苗(AS01E佐剂系统)」获国家药监局临床试验默示许可,拟开发用于预防由呼吸道合胞病毒RSV-A和RSV-B亚型导致的60岁及以上成人的下呼吸道疾病(LRTD)。这是全球首款获批的RSV疫苗,已于今年5月获FDA批准上市,用于预防60岁及以上人群因RSV引起的LRTD。在Ⅲ期临床AReSVi-006中,该疫苗的总体疫苗效力为82.6%。
6.河北森朗靶向CD7自体CAR-T获批临床。河北森朗生物拥有完全自主知识产权的1类生物制品“SENL101自体T细胞注射液”获国家药监局临床默示许可,适应症为成人复发或难治性T淋巴母细胞淋巴瘤/白血病(T-LBL/ALL)。SENL101是一款针对CD7阳性T细胞起源的血液淋巴系统恶性疾病开发的CAR-T产品。公布于ASH2022年会上的一项I/II期试验数据显示,SENL101治疗第28天,有95.8%患者的骨髓/外周血实现最小残留病灶(MRD)阴性的完全缓解(CR)。
7.君实PD-1/VEGF双抗报IND。君实生物1类生物制品注射用JS207临床申请获CDE受理。JS207是一款PD-1/VEGF双特异性抗体,可同时以高亲和力结合于PD-1与VEGFA,阻断PD-1与PD-L1和PD-L2的结合,并同时阻断VEGF与VEGF受体的结合,具有免疫治疗药物和抗血管生成药物的协同抗肿瘤作用。在临床前研究中,JS207已显示出积极的抑瘤作用,且具有良好的耐受性。该新药拟开发用于晚期恶性肿瘤的治疗。
8.邦耀新型腺嘌呤颠换编辑工具见刊。上海邦耀生物与华东师范大学李大力教授及刘明耀教授团队合作,开发出一系列新型腺嘌呤颠换编辑工具(AXBEs和ACBEs),为多元化的遗传操作和人类第二大类单碱基突变(SNVs)的基因治疗提供新的策略。ACBEs可以有望纠正很多由于C·G到A·T单点突变造成的遗传疾病,例如,苯丙酮尿症、鸟氨酸转氨酶(OTC)缺乏导致的高氨血症等肝脏代谢疾病和血友病B。研究成果于2023年6月15日在Nature Biotechnology杂志上发表。
国际药讯
1.口服粪便微生物疗法最新结果公布。Seres公司口服微生物组疗法Vowst(SER-109)治疗复发性艰难梭菌感染(CDI)患者的Ⅲ期临床(ECOSPOR III和ECOSPOR IV)最新结果积极。事后分析结果显示,在接受治疗前,经历首次复发或多次复发患者基线的肠道微生物组多样性均偏低。接受Vowst治疗后,首次复发和多次复发的患者群体肠道微生物组多样性均显著增加。此外,可以抑制艰难梭菌生长的代谢物胆酸的水平也有所增加。
2.双靶点RNAi新药启动皮肤癌Ⅲ期临床。Sirnaomics公司宣布启动一项评估其siRNA药物STP705治疗原位鳞状细胞皮肤癌(isSCC)的确证性Ⅲ期临床。STP705利用双靶向抑制特性和多肽纳米颗粒(PNP)增强递送直接敲低TGF-β1和COX-2的表达,降低组织的异常纤维化。该公司将在随机双盲、安慰剂对照临床研究中,进一步评估STP705治疗的效果。此外,Sirnaomics也正在推进 STP705用于治疗基底细胞癌 (BCC) 的相关研究。
3.安进启动O药生物类似药III期临床。安进在clinicaltrials.gov网站上登记启动一项III期临床,拟评估ABP206与PD-1抗体纳武利尤单抗(Opdivo)在黑色素瘤患者中的药代动力学(PK)相似性、有效性、安全性和免疫原性。根据安进研发管线以往的生物类似药产品编号,推测ABP206是Opdivo的生物类似药。据悉,O药和K药的美国序列专利将分别于2027年和2028年到期,中国序列专利将分别于2026年和2028年到期。
4.辉瑞ER靶向PROTAC启动新III期临床。辉瑞从Arvinas公司引进的ER靶向PROTAC蛋白降解疗法vepdegestrant(PF-07850327)登记启动第2项III期临床(VERITAC-3),旨在评估vepdegestrant联合哌柏西利对比标准治疗(来曲唑+哌柏西利)一线治疗ER+/HER2-、局部晚期或转移性乳腺癌患者的有效性和安全性。2022年12月,辉瑞已启动vepdegestrant对比氟维司群二线治疗ER+/HER2-晚期乳腺癌的III期临床试验VERITAC-2。
5.BLyS/APRIL抑制剂IgA肾病Ⅱb期临床成功。Vera公司创新BLyS/APRIL双重抑制剂Atacicept治疗IgA肾病(IgAN)的Ⅱb期临床ORIGIN达到主要和关键性次要终点。在意向治疗(ITT)患者人群中,atacicept(150mg)治疗组36周时患者蛋白尿指标较安慰剂组降低35%(p=0.012)。在排除未遵守试验方案的患者后,atacicept组的蛋白尿指标与安慰剂组相比降低43%(p=0.003)。今年6月,Vera公司已启动Ⅲ期临床,进一步评估atacicept治疗IgAN患者的效果。
6.BMS靶向CD19自体CAR-T早期临床积极。百时美施贵宝靶向CD19的CAR-T疗法Breyanzi(liso-cel)在治疗复发或难治性滤泡性淋巴瘤(FL)的Ⅱ期临床(TRANSCEND FL),以及治疗复发或难治性套细胞淋巴瘤(MCL)的Ⅰ期临床(TRANSCEND NHL 001)获积极初步结果。分析显示,Breyanzi在可评估复发/难治性FL患者中达到97%(95% CI:91.6-99.4;p<0.0001)总缓解率(ORR),其中94%为完全缓解(CR);在可评估MCL患者中达到86.5%的ORR,其中CR为74.3%。
医药热点
1.山东实施患者出院计划项目。近日,山东省卫健委印发《山东省住院患者出院计划项目实施方案》,以推动各医疗机构之间实现分工合作,让患者在不同的健康照护场所得到协调、延续的医疗照护,满足人们多元化、多层次的健康服务需求。山东省三级公立医院和二级公立综合医院根据工作实际,选择不少于50%的病区试点推进。
2.上海市级医院老年医学科专科联盟成立。6月13日,由复旦大学附属华东医院牵头组建的上海市级医院老年医学科专科联盟正式成立。该联盟的成立,旨在联合15家上海市级医院融入多种应用于老年人群的诊疗新技术及依托于信息化技术手段的整体化、连续性的共病评估与治疗新技术,同质化地推广到联盟成员单位、协同成员单位,凝练出多个覆盖老年医学的专家共识与标准,并积极推动多中心临床研究的开展,实现新技术成果转化,推动老年医学事业高质量发展。
3.下午运动或有助于糖尿病患者血糖控制。来自布列根和妇女医院的Jingyi Qian及其研究团队日前发表在Diabetes Care上的一项针对2型糖尿病患者的强生活方式干预研究(Look AHEAD)结果显示,在强生活方式干预下,每周在下午进行中到高强度的体力活动的人群糖化血红蛋白(HbA1c)水平下降幅度比其时间高出30%-50%,更有可能停止使用降血糖药物,并且这种效果与活动量和强度无关。
评审动态
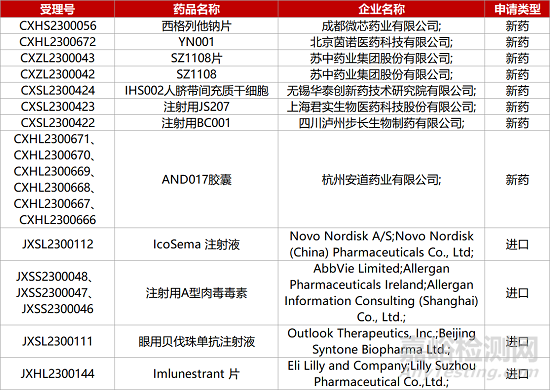
1. CDE新药受理情况(06月20日)
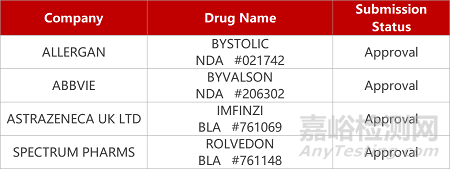
2. FDA新药获批情况(北美06月16日)