摘要
通过分析2016—2021年化学药改良型新药的申报审批情况,从化学药改良型新药的治疗领域分布、改良的剂型统计、优先审评审批数据等角度分别比较分析,以期为化学药改良型新药的研究开发提供思路和参考。结果表明在研发分类选择方面,选择2.2和2.4类改良型新药治疗往往会获得较高的注册成功率,其研发风险和技术难度相对较低,可以作为未来研究与开发的重点;在治疗领域方面,抗肿瘤药和免疫机能调节药、神经系统用药等是改良型新药的研发热门,符合我国政策导向;在剂型选择方面,高端制剂技术可作为2.2类改良型新药的研发切入口;在审评审批通过率方面,避免如注射用紫杉醇聚合物胶束等品种的“扎堆”申报。
关键词
改良型新药;新药开发;优先审评审批;化学药
2015年8月9日,国务院发布《关于改革药品医疗器械审评审批制度的意见》(以下简称《意见》),开启了我国药品审评审批制度的改革。《意见》调整了药品的注册分类,将药品分为新药和仿制药,新药分为创新药和改良型新药。2016年3月,原国家食品药品监督管理总局发布《化学药品注册分类改革工作方案》,改良型新药正式面世。此后,国家陆续出台改良型新药相关的申报资料要求和临床试验指导原则。
与全新靶点和结构的创新药相比,改良型新药具有更多可以借鉴的已知活性成分药品的研究数据,可缩短临床研发的周期[1]。因此随着制药工业技术的快速发展,介于创新药和仿制药之间的改良型新药逐渐成为医药企业研发的新热点。根据公开数据及报道,化学药2类改良型新药的注册受理走势整体呈上升趋势。在健康中国战略背景下,为做好新药研发布局,开辟药物的多层次创新通道,本文在分析化学药改良型新药的注册申请、批准数量的基础上,从化学药改良型新药的治疗领域分布、改良的剂型统计、优先审评审批数据等角度分别比较分析,以期为化学药改良型新药的研究开发提供思路和参考。
1、数据与方法
1.1改良型新药的定义及注册分类
改良型新药是指在已知活性成分的基础上,对其结构、剂型、处方工艺、给药途径、适应证等进行优化,且具有明显临床优势的药品[2]。明显临床优势指患者未被满足的临床需求,可以表现在通过改良已上市药品而提高有效性、改善安全性和/或提高依从性等[3]。
根据《国家药监局关于发布化学药品注册分类及申报资料要求的通告(2020年第44号)》,化学药改良型新药注册分类分为以下4种,见表1。
1.2研究方法
本文将米内网、药渡数据库和戊戌数据库中检索的数据使用Excel2016进行分类、整理,并按受理号进行申报、批准数量(临床试验或生产)、治疗领域分布、剂型等情况的描述性统计分析。
2、化学药改良型新药申报情况及特点分析
2.1申报数量
2.1.1总览申报趋势
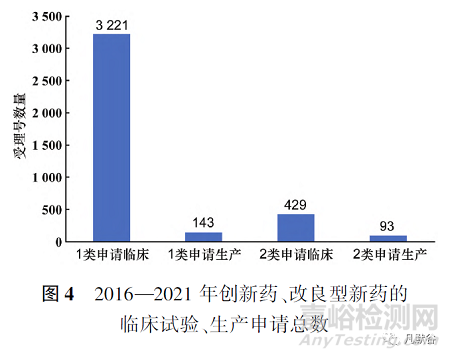
2016—2021年化学药改良型新药申请临床试验与申请生产的数量逐年上升,研究积极性高涨。6年间受理号共522个,其中申请临床数为429个,申请生产数为93个,见图1。
2.1.2对比创新药与改良型新药的申报情况
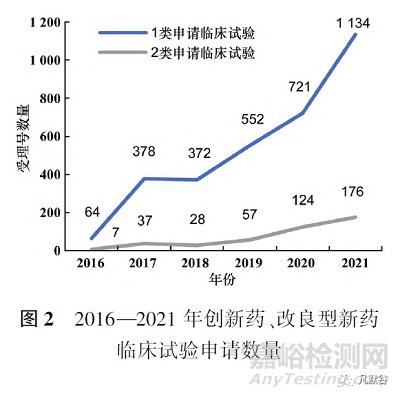
根据国家药品监督管理局药品审评中心(CDE)《2021年度药品审评报告》中1类创新药申请数据以及药渡数据库相关数据,与2类改良型新药相比,总体数量上创新药在临床试验申请和生产申请上都远超改良型新药[4]。临床试验申请上,如图2所示,创新药和改良型新药的申请数量都不断上升,但改良型新药的申请数量与创新药相比还存在一定差距,改良型新药的发展水平仍有待提升。生产申请上,2019和2021年改良型新药的申请数量出现小幅度反超,见图3。
此外,2016—2021年化学药改良型新药,无论是申请临床试验还是申请生产,申报的注册分类大部分集中在2.2类和2.4类,2.1类和2.3类数量较少,甚至为0,见图4和图5。
2.2申报所涉及治疗领域
本文采用ATC代码(解剖学治疗学及化学分类系统,简称ATC系统,是WHO对药品的官方分类系统)进行分析统计,发现治疗领域占比如表2所示。从临床试验申请来看,受理号数量排在前列的依次是抗肿瘤药和免疫机能调节药、神经系统用药、消化系统及代谢用药和系统用抗感染药,这些领域占总申报量的74.13%。从生产申请看,受理号数量排在前列的依次是抗肿瘤药和免疫机能调节药、神经系统用药、系统用抗感染药和消化系统及代谢用药,这些占总申报量的82.79%。
2.3申报品种的改良剂型分布
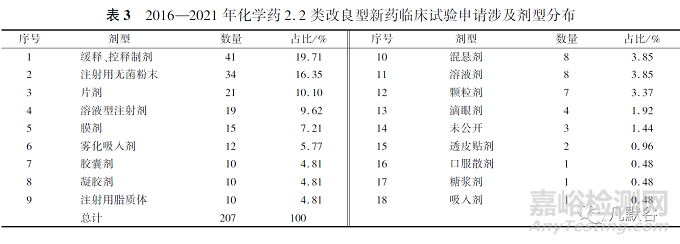
根据剂型对2016—2021年2.2类化学药申请临床试验的数据进行统计,改良后的剂型为缓控释制剂、注射用无菌粉末和片剂的数量位列前3,见表3。
3、获批情况及特点分析
3.1品种获批数量
从图6可见,2016—2021年化学药改良型新药申报临床试验的批准数量,总体呈上升趋势,2016年批准临床试验的数量只有6个,而2021年就已达到160个。
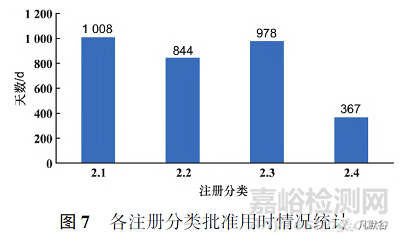
此外,批准临床试验申请和生产申请的2类化学药,在申报的注册分类上数量依然集中在2.2和2.4类,和申请临床试验、生产的数量呈现相似的特点。本文对批准生产的2类化学药用时(从国家或地方药品监督管理局受理生产申请之日起,到批件发放之日止所用时长)进行统计后发现,平均批准用时最短的是2.4类,最长的为2.1类,各注册分类具体平均批准用时见图7。而纳入优先审评审批通道的改良型新药品种平均批准用时少于一般品种,见图8。
3.2化学药改良型新药审批通过率
2016—2021年化学药改良型新药申请生产的通过率见图9。其中部分药品仍在审评审批中,因此在统计时,本文仅针对有审评结论的药品计算审批通过率。对未批准受理号分析发现,2020年未被批准上市药品,如丁苯酞注射液(用于急性缺血性脑卒中患者神经功能缺损的改善)申请集中度较高。有药企在2020年就提交了该药的上市申请,但未被批准,2021年又再次提交。此外2021年还有多家企业提交了丁苯酞注射液的临床试验申请,除去改良型新药还有仿制药申报,丁苯酞的竞争激烈程度越来越明显。因此,该药集中度较高,也存在一定的研发风险,这些药品也并不在国家倡导优先审评审批的政策范围内。
3.3批准品种涉及治疗领域
从表4中可以看出,2016—2021年批准临床试验的品种其治疗领域集中在抗肿瘤药和免疫机能调节药及神经系统用药、消化系统及代谢用药等;批准生产的品种其治疗领域集中在抗肿瘤药和免疫机能调节药、神经系统用药、系统用抗感染药等。
4、2016—2021年化学药改良型新药优先审评审批数量分析
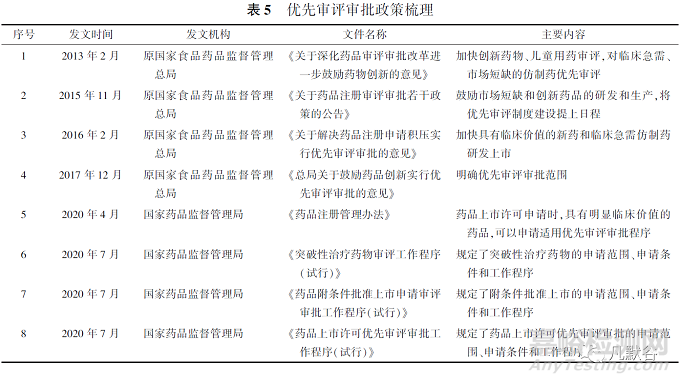
4.1优先审评审批政策梳理
2016年起,CDE正式开启优先审评审批工作,我国关于优先审评审批的政策梳理见表5。
4.2、2016—2021年化学药改良型新药优先审评审批的数据分析
新版《药品注册管理办法》于2020年10月1日实施,其中首次提出4个药品审评审批的加快通道:突破性治疗药物、附条件批准、优先审评审批和特别审批程序。根据药渡数据库,2016—2021年期间CDE共受理了45个符合加快通道的改良型新药的受理号。由于附条件批准、突破性治疗、特殊审批3个加快通道的受理号过少,现对CDE受理的优先审评审批的30个符合加快通道的改良型新药的受理号做以下分析,见图10,其显示了优先审评审批通道中不同药品优先审评审批通过理由的分布情况。
其中,16个受理号通过优先审评审批的原因是国家药品监督管理局规定的其他优先审评审批的情形。图11展示了由国家药品监督管理局规定的其他情形获得优先审评审批的受理号原因分布,超过一半的受理号获得优先审批的原因是使用先进制剂技术、创新治疗手段和具有明显治疗优势。而在重大疾病防治中具有清晰的临床定位的中药注册申请、专利到期前3年的药品临床试验申请和专利到期前1年的药品受理号数量暂时为0。
5、分析与讨论
5.1数据分析
5.1.1不同分类的改良型新药其改良方向难易有别、研发成本存在差异
申报和批准数据主要以2.2和2.4类为主,2.2类和2.3类数量较少,原因是不同改良方向的难易有别,研发成本上也存在一定的差异。2.2类改良型新药主要通过剂型优势体现药物临床优势。2.4类改良型新药将新适应证作为改良的方向。由前述治疗领域分布情况可知,抗肿瘤药领域的改良型新药数量较多,尤其是以改适应证为方向的2.4类药。其原因是新出的抗肿瘤药满足治疗某一种肿瘤的条件,但随着研究深入和治疗时间延长后,发现对其他肿瘤也有效,于是药企会以此作为改良的新适应证再次申报。
2.1类和2.3类改良型新药申报和批准的数量较少,一方面目前国内药企研发实力仍有待提高,只有极少数药企具有开发这类新药的能力;另一方面这2类新药必然需要做大型临床研究以证明其疗效,研发时间长、风险相对较大、研发成本高。
5.1.2药品治疗领域的分布集中在抗肿瘤药等领域
由表4和表8可以看出,改良型新药的申请和批准所涉及治疗领域分布均集中在抗肿瘤药和免疫机能调节药及神经系统用药,由此可见抗肿瘤药和神经系统用药是当前改良型新药研发的热点。
5.1.3药品依靠先进制剂技术等通过优先审评审批
2016—2021年化学药改良型新药优先审评审批通过的受理号数量为30个,占总批准受理号数量的55.56%。此外,改良型新药的研发其根本要求是具有明显的临床优势和价值,从数据中可以发现大部分药品优先审评审批的原因是使用了先进的制剂技术、创新治疗手段和药品具有明显治疗优势,以此适应临床需求、满足临床价值。
5.1.4从审批通过率中发现存在“扎堆”现象
通过观察2016—2021年化学药改良型新药申请生产的通过率,发现有些药品的研发状态渐至饱和,如上述分析中提到的丁苯酚注射液,已存在“扎堆”研发的情况,此外该药品也不在国家鼓励倡导的药品研发政策范围内,因此建议企业尽量规避研发这些方向的药品。
5.2化学药改良型新药研发的启示
5.2.1优先研发2.2和2.4类改良型新药,探索药物的新剂型和新适应证
具备一定研发实力的药企或者正在转型的仿制药企业,若想将思路聚焦于改良型新药的研发,可以优先考虑研发2.2类和2.4类的化学药改良型新药,探索药物的新剂型和新适应证。从以上统计可以看出2.2类改剂型的改良型新药研发势头向好。相比于其他的改良类型,做剂型改造时技术的可复制性会更高,药企可以“摸着石头过河”,参考目前我国正在做的剂型改良,并结合具体的品种申报书来看改良后的优势所在,从而为2.2类改良型新药的研制提供启发。
5.2.2以政策为导向聚焦抗肿瘤药物与神经系统用药的改良
根据数据分析可知,抗肿瘤药物和神经系统用药是目前的研发热点。2021年《“十四五”医药工业发展规划》中提出要重点发展针对肿瘤、自身免疫性疾病、神经退行性疾病、心血管疾病、糖尿病、肝炎、呼吸系统疾病、耐药微生物感染等重大临床需求的化学新药[5]。抗肿瘤药、神经系统用药不仅是我国化学药改良型新药的研究热点,也是政策支持的导向。建议药企从以下2个思路去探索:①抗肿瘤药物和神经系统用药的研发成功率较高,且符合政策导向,药企可以继续在该2类治疗领域深入研究改良型新药的研发。②抗肿瘤药物和神经系统用药已成为研发热门,为避免这2类治疗领域过于饱和,竞争激烈度较大,药企也可以另辟蹊径,去探索研发其他冷门治疗领域的改良型新药。
5.2.3以高端制剂技术为切入口开展2.2类改良型新药研发
从上述剂型统计可以看出,申请临床的2.2类改良型新药中,改良后的剂型有不少属于高端制剂。高端制剂通常具有改变药物的作用方式和速度、影响药物疗效、降低药物毒性等特点,而改良型新药所要求的“具有明显临床优势”,根据CDE发布的《化学药品改良型新药临床试验技术指导原则》[3],临床优势即患者未被满足的临床需求。在目标适应证中,对比已有的标准治疗,新药或新的治疗手段可显著提高疗效;或在不降低疗效的同时,显著降低当前用药患者的不良反应或用药的相关风险,或显著提高患者用药依从性。化学药改良型新药的临床优势也遵循上述原则,因此高端制剂技术所能达到的效果与改良型新药的要求契合度较高,利用高端制剂技术作为2.2类改良型新药的切入口是一条可行之路。
5.2.4避免某些品种的扎堆申报
在数据统计时发现,注射用紫杉醇聚合物胶束、注射用紫杉醇(白蛋白结合型)、孟鲁司特钠口溶膜、孟鲁司特钠凝胶、胶体果胶铋片、葡萄糖酸锌片液等品种,存在3家及以上企业共同申报的现象,建议企业在做改良型新药研发时提前了解品种竞争格局,避免扎堆申报造成研发资源的浪费。
6、结语
当前我国创新药的发展已迎来“黄金时代”,越来越多的医药企业争相涌入创新药赛道[6]。在仿制药竞争越来越大、新药靶点开发越来越难的情况下,相较于一类创新药而言,改良型新药无疑是一个好的选择。自2015年药品审评审批改革之后,我国不断出台一系列推动新药发展的政策,改良型新药申报数据不断上升。我国是仿制药大国,在完全创新和仿制之间开辟出一条新通道,对创新药、改良型新药、仿制药进行差异化分类,实施更为精准高效的监管,既能避免不必要的低水平重复,提高“新”的质量,又能为创新能力较低的企业提供一条可行之路。完全创新是一座难以逾越的高山,改良型新药的出现给积极转型的仿制药企业带来了曙光,在改良型新药市场持续扩大的情况下,医药企业想要趁机加入并突出重围,就要脚踏实地根据申报现状并结合自身研发实力做好立项。