无菌工艺模拟验证的边界取决于不同工序生产操作步骤是否属于无菌操作的范畴,包括且不局限于人员、物料、设备、公用系统、环境等。无菌工艺模拟验证的范围应从无菌工艺的第一步开始,经除菌过滤或其他方法获取无菌药液,直至无菌产品完全密封结束。
二、无菌工艺模拟验证的一致性或代表性
无菌工艺模拟的前提是需要对生产工艺有深入的认识和理解,能够识别和判断风险点的具体位置。无菌工艺模拟验证工艺应该与产品生产工艺尽可能保持一致,如何评价模拟验证工艺与生产工艺之间的一致性或模拟工艺验证的代表性,需要针对生产工艺和模拟验证工艺作对比分析,从产品无菌生产的角度评估两者之间差异所带来的潜在风险,最后确定模拟验证工艺。
以某个无菌水针产品为例,采用隔离器的一次性系统配液和灌装系统设计,整个工艺中,药液从配制开始,经过预过滤和除菌过滤,然后传输至隔离器内分液袋中,通过蠕动泵完成药液灌装,工艺流程图如下所示。
图:一次性系统工艺流程图
工艺模拟验证前需要对不同的操作单元作具体的对比分析,比如除菌过滤操作单元,使用前包含过滤器完整性的在线检测、工艺中存在缓冲液浸润除菌过滤并排放至废液袋的操作、一次性储液袋润洗等无菌操作,工艺模拟过程都应该尽可能模拟,若无法按照正常工艺进行,至少应该进行无菌风险评估或模拟实
际过程的操作动作,最大限度模拟到工艺过程中潜在的无菌操作风险。
三、无菌工艺模拟验证的考虑要点
从生产工艺流程而言,无菌工艺模拟验证包括前准备、培养基配制、除菌过滤、灌装、(冻干)、轧盖和灯检。每一个工艺环节的模拟想要实现与生产工艺完全一致,甚至都要模拟到“最差条件”是不可能的,但是我们可以做到工艺模拟能够代表实际生产工艺,保障生产过程的无菌性。因此,无菌工艺模拟验证的设计就显得尤为重要,实践过程中需要考虑的要点如下:
前准备:环境清洁消毒后有效期、设备、器具和内包材灭菌后的存放有效期应提前在模拟验证计划阶段考虑,尽可能满足多各因素在接近效期前实施,即考察不同条件下的“最差条件”。
培养基的选择和处理:培养基分为动物源性或植物源性两种,动物源性培养基应考虑培养基引入外源性病毒污染的风险,如BSE(可传染性海绵脑病)/TSE(疯牛病)的风险。培养基目前常用的处理方式为高温湿热灭菌,包括湿热灭菌或高温注射用水配制。
培养基配制:尽管培养基配制过程为非无菌操作,实际工艺模拟验证过程中也需要考察和覆盖生产工艺中药液配制的最长暴露时限,同时除菌过滤前还应该进行取样检测培养基pH和微生物限度,用于数据收集和后期可能出现问题后的原因调查。如采用间歇式除菌过滤,则需要增加中间过程取样或至少在除菌过滤结束前对培养基取样,用于测试微生物水平。
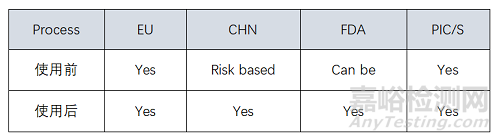
除菌过滤:不管工艺采取多级过滤还是冗余过滤系统,均需要考虑除菌过滤后药液管路的密封性/无菌性。除此之外,过滤器SIP前后完整性测试需要结合相关法规和指南要求执行,不同国家或地区对过滤器使用签后完整性要求如下:
如果采用不锈钢配液系统生产工艺,还应考虑初始罐体保压和罐内无菌性的验证。
取样:无菌工艺模拟过程中通常会进行除菌过滤后中间产品取样,证明除菌过滤系统的无菌性,无论是不锈钢储液罐还是一次性储液袋均应考虑设计无菌取样的操作,如增加无菌取样接口或一次性无菌取样袋。
灌装:模拟灌装过程应考察到生产过程灌装的最大速率和最小速率,尽可能覆盖到容器的最长暴露时长“最差条件”。如生产线上有多个容器规格,可以参考GMP指南无菌附录章节要求,通过风险评估选择一大一小进行工艺模拟。灌装结束后,系统中剩余培养基也应进行取样培养,以备后期可能出现的染菌调研使用。
冻干(适用于冻干制剂):冻干工艺模拟通常不模拟冷冻过程,避免培养基冻结,抑制微生物生长。冻干工艺模拟需要重点考虑和关注真空度和维持时间的代表性,比如模拟生产过程抽真空(GMP无菌指南推荐真空度为500mbar)和掺气过程(无菌空气/氮气/惰性气体)空气扰动、维持时间以及循环次数,循环次数需要企业通过风险评估或与测试进行确定。
轧盖:轧盖过程应按照正常生产过程开展密封完整性检查。轧盖结束后,所有轧盖剔废样品均需要进行灯检,判断密封完整性。
灯检:工艺模拟样品灯检仅需要检查容器的外观和密封完整性,除存在明显密封完整性缺陷样品可以剔除外(需要进行确认),其余所有样品均应该进行培养。
工艺时限:各工序的工艺时限模拟应涵盖工艺规定的最长时间,包括:除菌过滤时限、灌装持续时间、轧盖时限等。
四、总结
上述内容主要从无菌工艺的角度分享了不同操作单元在模拟验证实践过程中的一些注意事项。工艺模拟应该以生产工艺为核心,切实结合无菌生产过程所涉及到的环境、设备、人员、操作时限等因素,针对性地开展工艺模拟验证,避免出现工艺模拟无法代表生产工艺的情形。
参考资料
1.药品GMP指南(第2版) 无菌制剂。
2.PDA TR22 Process Simulation for Aseptically Filled Products。