近日,健世科技宣布,其自主研发的经导管三尖瓣置换系统,获选加入美国食品药品监督管理局(FDA)的产品全生命周期咨询计划(TAP),将有效加速其在美国的临床试验和商业化拓展进度。
公告发出后,健世科技开盘一度上涨超14%,直观地反映出市场对于健世科技的经导管三尖瓣置换系统LuX-Valve系列产品的认可以及公司未来发展的信心。
市场概况
弗若斯特沙利文预计,全球结构性心脏病介入医疗器械市场规模将由2021年的93亿美元增至2025年的198亿美元,年复合增长率为20.8%,并于2030年增至481亿美元。
海外市场具有多元化的购买方结构,以商业保险为主,这与国内单一的支付方模式形成鲜明对比。这种支付结构使整个产品价格体系更为稳定,并且随着产品的不断创新和迭代,部分产品的价格逐渐趋于稳定甚至略有提升。以TAVR为例,爱德华的Sapien系列自2011年在美国上市以来,单价基本维持稳定。
并且,海外市场受经济发展水平、医疗保健政策、健康意识以及医疗器械技术等多方面因素作用影响,如北美、欧洲等发达地区有着较强的商业保险支付能力以及患者支付意愿。
在北美市场,健世科技已在美国及加拿大地区完成数十例临床植入,持续推进经导管三尖瓣置换系统产品在北美地区的临床及商业化进程。预计在今年内正式进入EFS和IDE临床试验阶段。
在欧洲方面,持续在欧洲进行以获取CE认证为目标的临床应用。已经在法国、德国、西班牙、意大利、丹麦等欧洲主要国家及地区开展数十例临床植入,取得多国专家的一致好评。
在亚太区域,已成功开展多例收费同情救治使用,进一步提升公司在亚太地区的学术地位和商业化影响力。
从竞争格局来看,目前全球还未有一款三尖瓣介入置换治疗产品获批上市,相较于全球已经进入确证性临床试验阶段的三尖瓣介入置换产品,健世科技的LuX-Valve系列无论是在技术理念、临床进度和临床效果上,均有着领先优势。
产品介绍
对于健世科技而言,经导管三尖瓣置换系统进入TAP是其获得FDA授予突破性器械认定后的又一大里程碑事件,将进一步加速其在美国的临床和商业化进展。
简单来说,TAP旨在通过促进FDA与医疗器械厂商之间早期、频繁和战略性的沟通,以确保美国患者能够于未来几年内在全球范围率先获得高质量、安全、有效和创新的医疗器械。截止至2023年9月8日,FDA在TAP试点中仅纳入了9款器械。
健世科技的经导管三尖瓣置换系统能够获纳入TAP,一方面意味着产品的创新性,以及在治疗方面的安全性和适用性已经获得权威标准的认可,拥有值得期待的竞争优势。另一方面,FDA也将从战略和执行两个层面提供持续的支持,推动该产品后续在美国的临床和商业化进程。
图:来源于公司网站
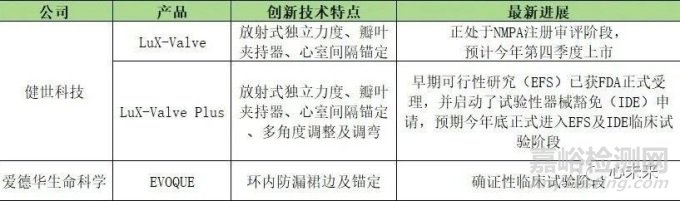
此外,一代产品LuX-Valve及二代产品LuX-Valve Plus均已进入NMPA创新医疗器械特别审查程序,多项国内外认可的资质更是直接彰显出健世科技在介入医疗器械方面强劲的技术实力。
目前,LuX-Valve已进入NMPA注册审评阶段且注册发补资料已递交国家药监局,有望成为全球首批上市的三尖瓣置换介入治疗产品。
若LuX-Valve顺利于今年第四季度在中国如期上市销售,后续其也将为该产品在美国及其他海外地区的商业化提供更多数据支撑,加速在美国的临床试验和商业化进程。
公司简介
宁波健世科技股份有限公司(简称:健世科技,股票代码:09877),成立于2011年11月,是一家立足中国、具有全球影响力的医疗器械公司,总部位于宁波,在北京、上海等地设有分公司、子公司。
健世科技战略性地围绕庞大、渗透不足且快速增长的结构性心脏病治疗市场,开发出针对不同类型结构性心脏病的全套治疗解决方案。
公司致力于开发用于治疗结构性心脏病的自主创新产品,以自主开发、原始创新理念为出发点,是中国少数拥有完整的结构性心脏病解决方案的企业。
公司产品包含了三尖瓣置换及修复、主动脉瓣置换、二尖瓣置换及修复和心衰系列产品。其中核心产品LuX-Valve经导管三尖瓣置换系统进入《2021欧洲心脏病学会/欧洲心胸外科协会瓣膜性心脏病管理指南》,并获得美国FDA授予的突破性器械认定。
此外,健世科技的其他管线临床也在稳步推进中。
例如,经导管主动脉瓣置换系统Ken-Valve已于今年上半年完成确证性临床试验的一年随访工作,即将向NMPA提交注册,预计2024年下半年获批上市。该产品有望成为中国第二款、全球第三款能够治疗主动脉瓣重度关闭不全(或合并狭窄)的主动脉瓣介入治疗产品。
经导管二尖瓣修复系统JensClip确证性临床试验入组已将近过半。经导管二尖瓣瓣叶增强系统JensFlag已成功完成数例人体应用,验证了二尖瓣瓣叶增强技术的可行性。
其全资子公司迪创医疗孵化的房间隔造孔支架系统MicroFlux和左心耳封堵器系统SimuLock亦均进入到正式FIM临床试验入组阶段,当前入组均顺利成功。