美国 FDA 对于药品前沿技术的发展进行快速响应,致力于促进创新产品的快速上市,最大限 度的满足公众健康需求。 本文拟通过对美国 FDA 药品前沿技术监管领域的相关政策、行动计划、技术指南 以及实施程序等进行分析总结,以期为我国前沿技术领域医药产品的科学监管提供借鉴。
科学和技术的进步为开发创新医疗产品提供了非凡的机遇,这些产品的问世为患者带来更好的治 疗体验、提高患者生存质量甚至挽救更多生命。 为了应对技术进步的速度快于新产品风险⁃获益科学 评价的发展速度,鼓励药品前沿技术的发展与应用, 美国FDA 时刻保持先进性和国际引领地位,开发了 一系列创新的监管新工具、新方法和新标准,将更多 的药品前沿技术推向市场,确保已上市药品的安全 有效,持续保障和促进公众健康。 本文主要介绍美国 FDA 在先进制造(advanced manufacturing)、药物开发工具、再生医学先进疗法 3 个方面的监管实践经验,以期为我国相关前沿技术领域的监管提供参考。
1、 先进制造
先进制造已成为全球趋势,引起许多国外监管 机构的高度重视。 美国 FDA 投入大量资金用于先 进制造相关项目,持续与业界合作,促进先进制造技 术的实施,让更多患者获益。
1.1 先进制造的含义 先进制造是提高药品质量、解决药品短缺问题并加快药品上市时间的新医疗产品制造技术的统 称,这些技术整合新的技术方法,以创新的方式使用 现有技术,或者在没有明确的最佳实践或经验的新 领域应用生产方法。 先进制造技术包括:1 连续制 造( continuous manufacturing,CM) 。 CM 提供了一种更快、更可靠的制药方式。 美国 FDA 正在促进这种 方法广泛使用。 CM将传统的逐步制造流程集成到 基于现代流程监控和控制的单一系统中。 在 CM 过 程中,产品是随着时间的推移而制造的,因此制药企 业可以轻松控制生产的产品数量以满足需求。 这些 高效、集成的连续系统仅需要更小的占地面积即可 运行。 2 增材制造(additive manufacturing,常被简 称 3D 打印,即 3DP):能够通过重复分层材料将数 字 3D 模型制作成实体零件。 这些方法可用于所有 医疗产品。 3DP 可以创建特定患者的医疗设备,如植入物、手术指南或解剖学模型。 同样,3DP 的固体 药物产品可以制成各种形状、规格以及活性和非活 性成分的分布。 同时正在研究组织工程的 3DP 构 造物可以推进再生医学。 这种方法提供可以生产出 适合患者个人需求的医疗产品的独特机会。 3DP 工 艺的能力和便携性也使复杂和先进的医疗产品在偏 远或艰苦条件下的分布式制造成为可能。
1.2 先进制造计划
根据美国 FDA 药物评价与研究中心(CDER)药品质量办公室(OPQ)2021 年度报告[1] ,OPQ 正 在努力通过 3 个关键举措实现建立先进制造技术。 1.2. 1 新 兴 技 术 计 划 ( emerging technology program, ETP) 为了促进制造生产中新技术的使用,CDER 于2013年启动新兴技术团队(ETT)的建立[2]。 2014 年底,CDER 制定了 ETP ,制药企业代表可以在 企业提交药品上市申请之前与美国 FDA 互动,以讨 论新型先进制造技术开发过程中的技术和监管问 题。 尽管该计划最初侧重于防止对新制造技术的审 评延迟,但制药商无需有已提交的注册申请即可参 与该计划。 ETP 不仅涵盖 CM,还涵盖无菌技术、模 块化制造、建模、人工智能 / 机器学习和智能制造等 其他领域。 为了满足业界申请的需求,进一步加速 新制药技术的采纳,CDER 正在为其新兴技术项目 增加人员,并逐步将新技术探索“ 毕业” 推进到标准 质量评价路径中。 2021 年,为进一步加强现有的流 程和结构,CDER 将 ETP 升级至 ETP 2.0,该计划包 括 13 个优先领域:毕业、知识管理和转移、管治、使 用、参与、沟通、技术和工具、技能和培训、工作量、管 理、策略以及意识[3] 。
在 ETP 中,毕业部分将分 3 个步骤进行:第 1 步,行业在准备监管申报时申请对新兴技术的意见 和反馈;第 2 步,新兴技术团队随后将与行业合作, 讨论、确定和解决与新技术开发和实施相关的技术和监管问题;第 3 步,该技术将不再被视为“ 新兴” 技术,而是通过标准的质量评价路径审评,称之为毕 业。 毕业提供了 3 个好处:1 使美国 FDA 能够获 得足够的技术经验,并相信行业将提交成功的未来 申请。 2 有能力接受未来的新兴技术,跟上行业创 新的步伐。 3 能够在继续满足《 处方药使用者付费 法案》(PDUFA)目标日期的同时审评更多申请。 目 前 ETP 2.0 已分阶段实施。 美国 FDA 的数据显示, 虽然 CM 应用仍然是 ETP 最常见的申请类型,但该 计划越来越多地应用于新型无菌技术。
1.2.2 先进制造评估监管框架计划(framework for reg⁃ ulatory advanced manufacturing evaluation,FRAME) CDER 制定了 FRAME 计划,以支持为患者带来获益 的先进制造技术[4] 。 FRAME 计划指的是 OPQ 资助 美国国家科学、工程和医学研究院(NASEM),帮助 收集制药企业对于未来 5 ~ 10 年先进制造技术的投 入,通过一系列研讨会,汇集了行业、学术界和政府 专家对于药品制造的未来发展共识,形成相关报告, 明确了美国 FDA 未来可能接收的新技术申报,这些 技术包括:端到端连续制造,一种整合原料药和制剂 的过程;便携式和模块化分布式制造平台,即所谓的 按需药房(pharmacy on demand)[5] ;制造中的人工 智能或高级建模方法。 2021 年,生物制品评价和研 究中心( Center for Biologics Evaluation and Research, CBER)和 CDER 联合成立了内部药品和生物制药 促进中心,以进一步调整美国 FDA 与 FRAME 相关 的思维和政策,促进对使用先进制造技术的药品申 请的审评[6] 。 作为计划的一部分,CDER 计划通过 讨论文件和研讨会征求利益相关者的意见,制订或 修订相关指南,并计划协调国际指南。
1.2.3 质量管理成熟度( quality management maturity,QMM)评级 2022 年 4 月 5 日,OPQ 发布了 《QMM 白皮书》[7] ,将 QMM 描述为“药品制造商拥 有一致、可靠和稳健的业务流程以实现质量目标并 促进持续改进所达到的状态”。 白皮书指出产品质 量高、供应链弹性低、药品持续短缺的现状,提倡美 国 FDA 与利益相关者建立 QMM 计划,建立科学基 金,鼓励利益相关者参与。 根据美国多机构联邦特 别工作组报告显示,许多药品短缺的根本原因是缺 乏激励措施,促进制造商在满足现行良好生产规范 (cGMP)基础上,具备努力开发成熟的质量管理体 系的动力。 因此,CDER 提出 QMM 评级系统,帮助 激励药品制造商在其设施中实现质量管理。 在缺乏QMM 评级透明度的情况下,价格竞争和成本最小化 是市场驱动的关键因素,特别是对于仿制药,而积极 投资以避免未来药物短缺的制药商却没有直接回 报。 成熟的质量管理是以绩效和以患者为中心的体 系确定需要改进的领域并实施有效的变革。 QMM 评级系统可以向监管机构和采购商通报药品生产设 施的性能和稳健性,并增加患者对药品可获得性的 信心。 QMM 评级还可以提高制造商在批准后进行 生产变更的灵活性,减少监管监督,激励持续改进。
美国 FDA 表示,要使这样的评级系统发挥作用,市 场需要奖励制药设施 QMM 评分较高的产品,在采 购决策中使用 QMM 评级应该激励长期的持续改 进,但不会在短期内将制药商挤出市场或显著提高采购成本。
1.3 美国 FDA 发布 / 实施的相关技术指南
美国 FDA 与制药企业合作制定了一系列先进 制造技术相关技术指南,阐明支持使用先进制造技术的产品所需的法规和数据要求,见表 1。
2、药物开发工具
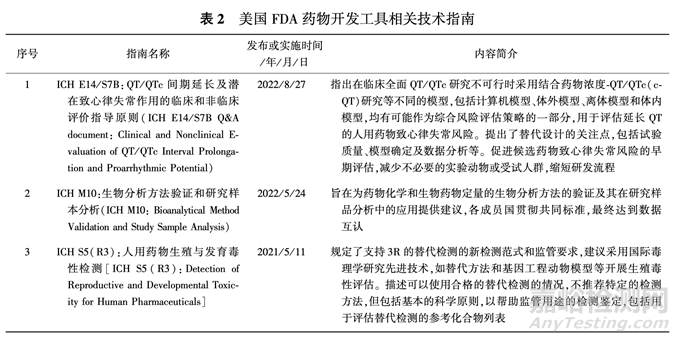
DDT的含义:DDT 是指促进药物开发的方法、材料或措施,用于降低开发美国 FDA 监管产品的时间、复杂性或 成本,同时提高产品开发的可靠性和稳健性。 DDT 包括新型生物标志物的开发、通过推进药效学( PD) 生物标志物的使用来提高生物类似物开发和批准的 效率、新技术用于提高非临床研究的可预测性,并替 代(replacement)、减少(reduction)和改进(refine⁃ ment)动物实验(以下简称 3R)。 目前美国 FDA 的 药物开发工具认证计划有 CDER 生物标志物资格、 临床结果评估资格、新药创新科学和技术方法 ( ISTAND) 试点计划、设备和辐射卫生中心( CDRH) 非临床评估模型等。
2.2 美国 FDA 药物开发工具的监管发展历程
2.2.1 关键路径计划( critical path initiative,CPI) 2004 年,美国 FDA 提出 CPI,其中指出生物医学上 诸多技术进步尚未显著助力药物和新疗法的研发, CPI 的一个重要作用是将先进的生物医学技术作为 新工具运用在药物开发过程中,加速安全、有效的新 医药产品研发上市。
2.2.2 生物标志物资格认定计划( biomarkers quali⁃ fication program,BQP) 2009 年美国 FDA 建立了 BQP,为行业建立生物标志物研发和认定平台,给予 生物标志物资格认定并公开提供支持信息,促进获 得资格认定的生物标志物资格的使用,鼓励药物研 发和监管决策中新的生物标志物的认定。 一旦生物 标志物获得资格认定,发起人可将其用于符合特定应用场景的药物研发计划,而无须 CDER 重新审查 相关支持性信息。
2.2.3 药物开发工具资格认定程序(qualification process for drug development tools, QPDDT ) 2010 年,美国 FDA 发布《 面向行业和 FDA 的药物开发工 具资格认定程序指南草案》,并于 2014 年正式发 布[8] 。 该指南由 CDER 生物标志物资格认定工作 组制定。
2015 年,CDER 建立了 QPDDT, 通过该程序鼓 励申办者公开获得认定的创新药物研发工具,促进 生物标志物临床结局评价工具(biomarkers clinical outcome assessments)、动物模型(animal models)等 创新性药物开发工具在药物研发中的推广使用,减 少新型开发工具的重复审评。 生物标志物日益成为 治疗特定疾病的医药产品研发的重要组成部分,因 此 QPDDT 中最重要的就是生物标志物资格认定项 目,医药产品研发中作为有效指标的生物标志物,经 该程序获美国 FDA 审评通过后即认定为合格的生 物标志物。
2016 年《21 世纪治愈法案》 促进国家精准医学 行动的倡议的落实,在对疾病的分子水平理解的基 础上,进一步推动疾病预防、诊断和治疗产品的研 发。 《联邦食品、药品和化妆品法案》(FD&C)新增 第507节“药物开发工具资格”认定条款。 2019年 12 月《 药物开发工具的资格认定程序指南草案》 全 面修订后再次同名发布。
2.2.4 ISTAND 试点计划 为了支持、简化可能加 速药品开发的新技术,美国 FDA 于 2020 年 11 月 30日启动了 ISTAND 试点计划,并于 2021 年继续实施 该计划。 该试点为尚无监管途径的新颖方法提供提 交途径,旨在鼓励开发现有 DDT 资格认证计划范围 外但对药物开发有益的 DDT,支持开发可行的新型 药物开发方法。 ISTAND 由药品审评科学办公室 (Office of Drug Evaluation Sciences,ODES) 领导,鼓 励开发和使用新的 DDTs,这些 DDTs 的特点是整合 了科学和技术的最新进展,但目前没有明确路径以 及 DDT 确认程序。 申办者通过 ISTAND 试点项目 的提交程序提交相关申请,一旦合格,DDT 就可以 在合格的使用范围内用于相关药物的开发。 此外,合格的 DDT 一般可被纳入新药 IND,NDA 或 BLA 中,而不需要美国 FDA 重新考虑和确认其适用性。
同时,通过 ISTAND 试点计划,对于不适合现有 的 DDT 资格认证模式但仍对药物开发具有潜在价 值的其他项目,美国 FDA 监管人员可以与申办者召 开一系列会议,提出相关研究意见;举行公开会议, 征求对新方法的意见;编写“白皮书”,提出实施新 型 DDT 的考虑;制定指南,说明美国 FDA 在药物开 发中使用该新工具的立场;或以其他方式向美国 FDA 提供意见和建议,以支持 DDT 的进一步发展。 2.2.5 新替代方法计划 2011 年,美国国立卫生研 究院( NIH) 、美国 FDA 与美国国防高级研究计划局 (DARPA)联合项目立项,推出了“微生理系统”计 划(MPS 计划),把器官芯片(organs⁃on⁃chips,OoC) 技术的开发和应用上升到国家战略层面。 2022 年 6 月,通过《食品和药品修正案》,将器官芯片和微生理系统作为独立的药物非临床试验评估体系纳入法 案。 2022 年 6 月 14 日,美国 FDA 发布的《促进监管 使用的替代方法》 报告,阐述了美国 FDA 提议的新 替代方法计划,包括美国 FDA 提议的新替代方法计 划、各产品领域的具体考虑、新的替代方法应用研究 和在监管受理案例(心脏安全、发育和生殖毒性)、 摘要和后续计划。 2022 年 12 月,美国参众两院共 同通过美国 FDA 现代化法案 2.0(FDA Moderniza⁃ tion Act 2.0) ,取消 FD&C 对新药和仿制药进行动物 实验的强制要求,旨在未来几年里大幅减少动物实 验的使用,推进包括器官芯片在内的多样化临床前 测试模型,减少动物的使用;将非临床实验定义为细 胞实验、器官芯片和微生理系统、计算机模型、其他 非动物或人生物学方法和动物实验,提供了器官芯 片和微生理系统在内的可作为药物注册支持性数据 的一种可能。 2023 财年,总统预算提议为实施跨机 构的新替代方法计划提供资金,以鼓励采用新替代 方法进行监管,以替代、减少和改进动物实验并提高 非临床试验的可预测性,简化美国 FDA 监管产品 的开发,更快、更高效地将产品带给美国公众和患 者,确保产品安全、有效、可信赖。
2.3 美国 FDA 发布 / 实施的相关技术指南
美国 FDA 通过监管项目的实施,推动制定一系 列技术指南,加速新的药物开发工具的应用与采纳, 满足制药技术发展需要,为监管决策提供参考,包括 美国 FDA 与利益相关者共同制定的技术指南以及监管接受的IC H指南,见表2.
3、 再生医学先进疗法(regenerative medicine ad⁃ vanced therapies,RMAT)
3.1 RMAT 含义
美国于 2016 年 12 月发布《21 世纪治愈法案》 中提出 RMAT,为有生命危险的患者提供接受尖端 医疗的创新审批途径。 通过 RMAT 认定的医疗产 品,可以在临床试验早期更频繁地与美国 FDA 交 流,获得优先审查和加速审批,能够更快更精简地获 批,从而缩短产品上市时间。 RMAT 认定需要满足 以下 3 个条件:1 该药物是一种再生医学疗法,其定 义为细胞疗法、治疗性组织工程产品、人体细胞和组 织产品,或使用此类疗法或产品的任何组合产品,《 公 共卫生服务法》第 316 条(PHSA 361)和《联邦法规 21 章》第 1271 条(21CFR Part 1271) 单独规定的除外。 2 该药物在治疗、改变、逆转或治愈严重或危及生命 的疾病或状况。 3 初步的临床证据表明,该药物有 潜力解决此类疾病或状况未得到满足的医疗需求。
RMAT 资格认定申请必须与 IND 或 IND 的修 正补充申请同时向 CBER 下属的治疗产品办公室 (Office of Therapeutic Products,OTP) 提交,包括:该 药物是否符合 RMAT 的定义;药物如何达到预期治 疗标准;药物有潜力解决此类疾病未满足的医疗需求的初步临床证据。
3.2 RMAT 产品的监管进展
3.2.1 RMAT 的特点 RMAT 产品提供了全新的治 疗途径,对亟待解决的医疗需求作出贡献。 RMAT产品具备以下特征:1 原料细胞的质量参差不齐, 难以评估。 2 考虑到目标疾病的特点,可入组临床 试验的患者数量有限。 3 如果涉及手术移植,在使 用对照组进行比较实验时存在伦理问题。 4 可能 需要长时间收集和评价数据,以确认有效性和安全 性。 因此,按照目前的常规药物开发规模,RMAT 产 品的临床试验可行性显著降低,且需要很长一段时 间才能将产品投入国际使用,研发和监管的难度较 常规药物更大。
3.2.2 RMAT 的加速计划 近年来,再生医学领域 得到迅速发展。 RAMT 具有治疗严重疾病的潜力, 特别是针对医疗需求未得到满足的患者。 CBER 认 识到再生医学疗法的重要性,为了帮助确保 RMAT 产品获得许可,2017 年 2 月发布了《 针对严重疾病 的再生医学疗法的加速审批程序》,基于 RMAT 的 特点,针对再生医学疗法提出 5 种加速计划,包括 快速通道认定、突破性疗法认定、RMAT 认定、优先 审评认定和加速批准[9] 。 本文结合《 针对严重疾 病的药物和生物制剂的加快审批程序》(2014 年 5 月)[10] ,对比了 5 种加速程序在纳入标准、政策获 益、申请提交时间以及美国 FDA 回复时间等,见表 3。 其中,RMAT 与突破性疗法认定之间的关键区别 是 RMAT 不要求申办者提交研究用药物与现有疗 法相比的实质性改善相关资料。 如果某些产品获得 RMAT 认定并通过加速审批,则可以优先满足某些 上市后要求。
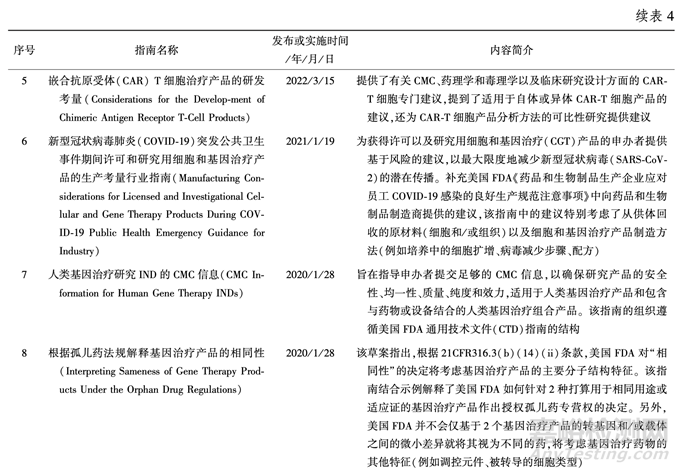
3.3 美国 FDA 发布/ 实施的相关技术指南 为了促进 RMAT 产品的研发和上市进程,美 国 FDA 基于现有的监管认知,发布了一系列技术指南,提出有效、基于科学的指导原则,以支持该 领域的研究。 截至目前,已发布了 17 项技术指南, 见表 4。
3.4 美国RMAT实施现状
RMAT 产品不仅要求具备创新性且能够符合未满足的临床治疗需求。 根据美国 FDA 官网数 据,截至 2022 年 12 月 31 日,美国 FDA 共接收了 203 个 RMAT 认定产品的申请,其中已同意 82 项 (见表 5),覆盖用于儿童先天性心脏病、细胞淋巴 瘤等疾病治疗领域[11] 。 由该项数据可见,美国 FDA 推行的一系列鼓励政策和技术指南有效促进了基因和细胞治疗产品的申报,但最终获得 RMAT 资格认定的产品仅 40%,认定的门槛较高。 美国 FDA 目前仅批准了 3 款 RMAT 认定的产品,分别 是 Mallinckrodt 制药公司的皮肤再生组织制品 Stratagraft(2017 年 7 月)、住友制药母公司旗下的 Enzyvant 集团公司的小儿先天性无胸腺症治疗药 物 Rethymic 和百时美施贵宝的治疗大 B 细胞瘤产 品 Breyanzi。
4、 对我国的启示
4.1 完善法律法规和指南框架 鼓励和推进新工具、新方法、新标准的制定总结美国监管实践可以看出,其支持前沿技术 的创新落实在国家战略、立法层面以及指南框架的 构建等各方面:1 为了支持药物研发工具的发展, 美国将器官芯片和微生理系统作为独立的药物非临 床试验评估体系纳入《食品和药品修正案》法案。 2 美国参众两院联合通过美国 FDA 现代化法案 2. 0,取消 FD&C 对新药和仿制药进行动物实验的强 制要求,而我国目前尚无与《 食品和药品修正案》 和 FD&C 类似的对于替代方法的相关要求。 3 美国 FDA 围绕再生医学疗法制定了灵活的审评标准和 技术要求,显著降低细胞和基因治疗产品的研发成 本。 建议我国参照美国 FDA 的实践经验,在国家战 略层面形成长期工作计划,完善相关前沿技术法律 法规依据和指南框架,引导前沿技术健康发展。
4.2 构建监管机构与产学研管组织更广泛的沟通协作平台
目前我国药品监管过程缺少产学研用平台的联 合参与,虽在持续关注相关技术方法的研发进展,但 研发和监管尚未形成良性沟通,研发和验证、具体应 用脱节,不利于相关技术方法在具体药物研发中的 转化落地。 建议将产、学、研、管有机结合,建立良好 的沟通机制,在沟通中形成共识,在共识中促进转 化,强化医保、卫健、药监等政府部门、产业界、临床 研究机构与前沿技术之间的互信互认,打通技术向 应用实践转化的壁垒。
4.3 深度参与药品监管国际交流与合作
作为 ICH 成员国,我国应通过拓展双边、多边 合作交流合作机制,积极参与全球药品监管研究,主 动参与国际规则制定,及时掌握创新药物研发的新 趋势、新问题[12] 。 2023 年 6 月 ICH 温哥华会议正 式通过了美国生物技术创新协会(BIO)提交的《关于细胞和基因治疗产品监管国际协调战略路径的建 议书》,标志着 RMAT 作为全球生物医药未来发展 的重点方向,将是 ICH 等国际药品研发和监管标准 协调的重点领域之一。 我国已通过“ 中国药品监管 科学行动计划” 先后制定了 15 项细胞和基因治疗 产品相关技术指导原则,基本与国际同步,应当把握 当前的技术前沿优势。 增强政策支持和资源配置, 定期研究调整或增加“中国药品监管科学行动计 划”研究项目和药品监管科学全国重点实验室任务 清单,提高监管科学研究的针对性,提升国际话语权 和前沿技术协调主动权。
5、 结语
面对创新技术的迅速发展,药品监管机构的能力要求已经不是传统意义上的知识缓慢积累,而是 爆炸式的知识涌入。 为了弥补当前国家医药创新转 化链条明显的短板,我国应集中优势资源,在“ 中国 药品监管科学行动计划” 取得积极成效的基础上, 在“ 十四五” 期间全面强化药品监管科学体系建设, 为中国式现代化药品监管实践提供科技支撑和引 领。 依托药品监管科学全国重点实验室、监管科学 行动计划等平台,集中优势力量,针对创新产品特 性、行业问题、监管需求,研究制定各类前沿技术评 价的新工具、新标准、新方法,在研发的全链条协助 企业规避风险,实现顺畅转化,不断提高创新药物的 成药性评价水平,最终带动整个产业的高质量发展, 保障和促进公众健康。