您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-09 11:08
摘要:近年来,国内外双特异性抗体发展迅速,截至2023年12月,全球已有近200个双特异抗体正在进行临床研究,10余个双特异性抗体药物获批上市。本文分析了国内外双特异性抗体注册申报现状,并结合药学审评经验及相关文献,对此类产品药学开发中的常见技术问题进行探讨,以期为双特异性抗体药物的药学开发及评价提供参考。
NISONOFF等[1]在20世纪60年代首次提出将不同特异性的单价抗体片段的混合物重组,自此双特异性抗体(简称双抗)的发展拓展了癌症免疫治疗领域。但由于免疫原性和链错配问题的存在,双抗的发展受到了很大限制,近年来,随着科学技术的快速发展以及对双抗认知的提高,这些问题已逐渐被克服。双抗由于能同时结合2个不同的靶点或同一个靶点的2个不同表位而具有更强的抗原结合能力,在复杂疾病的治疗中十分关键[2]。LAN等[3]报道,靶向人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的双抗已显示出将免疫细胞定向至HER2阳性乳腺癌细胞的能力,从而有效杀伤肿瘤细胞。已完成的临床研究显示,Roche的法瑞西单抗(Vabysmo)靶向血管生成素-2(angiopoietin-2,Ang-2)和血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A),用于治疗新生血管性或湿性年龄相关性黄斑变性和糖尿病黄斑水肿,相比1~2个月眼部给药1次的阿柏西普,Vabysmo在达到同样治疗效果下可将给药时间延长至3~4个月,有效降低了治疗负担[4]。
自2009年首个双抗卡妥索单抗(Catumaxomab)批准上市以来,多个双抗药物进入研发的不同阶段。截至2023年12月,全球已有近200个双抗正在进行临床研究,10余个双抗药物获批上市。本文分析了国内外双抗注册申报现状,并结合药学审评经验及相关文献,对此类产品药学开发中的常见技术问题进行探讨,以期为双抗药物的药学开发及评价提供参考。
1、 国内外双抗药物受理情况分析
1.1 国外已上市双抗情况分析
根据已经公开的信息,截至2023年底,全球已获批14款双抗药物(包括已退市的),其中10款为2022年后上市。获批的双抗药物涉及的靶点多样,包括分化簇3(cluster of differentiation 3,CD3)、分化簇19(CD19)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、细胞间质上皮转换因子(cellular-mesenchymal epithelial transition factor,c MET)、程序性细胞死亡蛋白-1(programmed cell death protein-1,PD-1)、细胞毒性T淋巴细胞相关蛋白-4(cytotoxic T lymphocyte associated protein-4,CTLA-4)、B细胞成熟抗原(B cell maturation antigen,BCMA)、凝血因子Ⅸ(coagulation factorⅨ,FⅨ)、凝血因子Ⅹ(FⅩ)、VEGF-A和Ang2等。适应症多为血液瘤、多发性骨髓瘤、消化道肿瘤、非小细胞肺癌、黑色素瘤等恶性肿瘤,也进行了血友病、眼科及关节炎等适应症的扩展探索。见表1。
全球已上市双抗药物中,有4家已在国内获批上市,包括Amgen的贝林妥欧单抗、Roche的艾美赛珠单抗、法瑞西单抗、格罗菲妥单抗,其中贝林妥欧单抗在国外获批5~6年后在国内上市,Roche的3种双抗国内外获批时间从1年逐渐缩短至1月,可见双抗在国内的上市时间与欧美的差距逐渐缩短,这得益于国内近年来加快审评、审批的各项举措及国际多中心临床的开展,明显提高了国内用药的可及性。在国内进行新药上市申请且处于审评中的包括Janssen的特立妥单抗、Roche的莫妥珠单抗、Johnson&Johnson的埃万妥单抗。
表1 国外已上市双抗药物汇总
Tab.1Summary of foreign marketed bispecific antibody drugs

注:FDA(Food and Drug Administration)为美国食品药品监督管理局;EMA(European Medicines Agency)为欧洲药品管理局;NMPA(National Medical Products Administration)为国家药品监督管理局;Ep CAM(epithelial cell adhesion molecule)为上皮细胞黏附分子;Gp100(glycoprotein 100)为糖化蛋白100;TNF-α(tumor necrosis factor-α)为肿瘤坏死因子-α;CD20(cluster of differentiation 20)为分化簇20;GPRC5D(G protein-coupled receptor,class C,group 5,member D)为G蛋白偶联受体C5D。
国外已上市双抗药物在我国正开展临床试验的包括Pfizer的Elranatamab、Johnson&Johnson的Talquetamab、Abbvie/Genmab的Epcoritamab-bysp,目前在国内均已进入关键的临床试验阶段。除此之外,全球尚未上市,国内外同步开展临床试验,且已进入关键临床试验的包括卡妥索单抗(Catumaxomab)、Amgen的Tarlatamab(靶点CD3E x DLL3)、Medimmune Llc研发的Volrustomig(PD-1 x CTLA4)、诺和诺德制药的Mim8(靶点F9 x F10)、阿斯利康的Gefurulimab(C5抑制剂)、默克雪兰诺的Bintrafuspalfa(靶点PD-L1 x TGF-β)、Zymeworks Inc的Zanidatamab(靶点HER2)、Abl Bio Inc的TR-009(靶点DLL4 x VEGFA)。值得注意的是,首个双抗药物卡妥索单抗(Catumaxomab)于2009年被欧盟批准上市,用于恶性腹水治疗,于2017年因商业原因退出市场。广州凌腾生物医药有限公司重启了卡妥索单抗在国内的开发,目前最高研发阶段为临床Ⅲ期,用于治疗胃癌[5]。
1.2 国内双抗注册受理情况分析
中山康方生物医药有限公司的卡度尼利单抗注射液(代号:AK104,商品名:开坦尼)已于2022年6月由NMPA获批上市,靶向人PD-1和CTLA-4,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者,是全球首个获批上市的肿瘤双免疫检查点抑制剂双抗,也是国内首个获批上市的双抗[6]。新药上市申请方面,中山康方生物医药有限公司研发的依沃西单抗(AK112)是一种特异结合人VEGF和PD-1的人源化双抗,用于治疗联合培美曲塞与卡铂用于经EGFR酪氨酸激酶抑制剂(epidermal growth factor receptortyrosine kinase inhibitor,EGFR-TKI)治疗后进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌(non-small cell lung cancer,NSCLC),目前已申请上市,处于审评中。
除已上市及正申请上市的品种外,国内双抗药物的临床研究也取得了阶段性进展,截至2023年底,中国大陆已有152个双抗获得临床试验申请(Investigational New Drug,IND)的批准,用于基于免疫肿瘤学的癌症及自身免疫性疾病治疗,且已成为双抗临床开发的重点。根据靶点组合和适应症的区别,主流的双抗类型可分为3类:含PD-1/PD-L1轴类、CD3招募类及其他类。目前国内处于临床Ⅲ期的双抗见表2。
2 双抗药学审评中常见问题及思考
双抗具有与单抗相似的理化性质,单抗典型质量研究方法大部分也适用于双抗,但双抗由于分子固有特性、特异性纯化工艺、产品相关杂质与单抗存在一定差异,质控研究又有自身特点。本文结合审评经验,列举了双抗药物审评中常见药学问题,着重强调了质量研究中可能遇到的问题,以期为双抗药物的药学开发及评价提供参考。
表2 国内处于临床Ⅲ期的双抗药物
Tab.2Domestic bispecific antibody drugs in clinical phaseⅢ
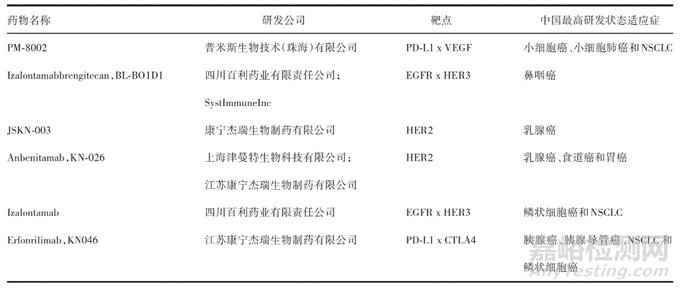
注:PD-L1(programmed cell death 1 ligand 1)为细胞程序性死亡-配体1;HER3(human epidermal growth factor receptor 3)为人表皮生长因子受体3。
2.1 双抗特异性
FDA于2021年5月发布的《Bispecific Antibody Development Programs Guidance for Industry》[7]在双抗药学研究和控制(Chemical Manufacturing and Control,CMC)方面提出,应研究可能影响药理学的质量属性,包括抗原特异性、与抗原表位结合的亲和力、与抗体结合的亲和力(针对同一细胞上的2个分子的双抗)、效价、产品相关杂质(如聚集体、片段、同源二聚体及其他错配形式)、稳定性及半衰期等,并指出“某些情况下,FDA可能会要求将双抗与针对相同抗原靶点的已批准单特异性产品进行比较(与类似单特异性产品相比安全性和/或有效性应有所提高),以便为双抗的获益风险评估提供信息”,此处强调了双抗特异性的重要性,与仅具有组合效应的双抗相比,更倾向于特异性双抗。
双抗药物开发时比传统的单抗药物面临更多的挑战,如某些双抗形式可能显示出不如其母体单抗的药代动力学特性[8]。该研究评估了两种Ig G融合双抗形式(Ig G-ECD和Ig G-sc Fv)在食蟹猴体内的代谢,结果显示,两种Ig G融合双抗形式清除较快、较其单抗分子半衰期短,因此选择合适的双抗形式是开发的关键部分[9],通常需要大量的筛选研究工作,重点是提高稳定性,降低多反应性和自缔合潜力,去除免疫及消除化学和蛋白水解切割位点。早期的体外研究可能会对选择具有最佳亲和力和稳定性的工程细胞株具有指导意义。如文献报道,艾美赛珠开发时曾从40 000个双抗中筛选,针对靶向FIX x FX活性、药代动力学改善、溶解度改善、脱酰胺和去免疫等进行了优化,最终筛选出emicizumab。部分抗体通过添加透明质酸酶等辅料制备皮下注射剂型,以高浓度形式给药,延长半衰期,方便患者给药[10]。目前国内外制药企业构建了高通量双抗制备和筛选平台,如苏州康宁杰瑞生物科技有限公司的电荷排斥诱导双特异性(Charge Repulsion Improved Bispecific,CRIB)平台、武汉友芝友生物制药股份有限公司的Ybody、Roche双抗筛选平台、Merck的SPLIT INTEINS平台、赛诺菲的CODV-Ig等,为快速、高效获得高质量、疗效好的双抗提供了平台支持。
2.2 结构研究
部分双抗与Ig G单抗结构类似,分子较大,研发时采用传统的生物物理学工具,如圆二色谱(circular dichroism,CD)、傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)和差示扫描量热法(differential scanning calorimetry,DSC)等,对大的、多结构域蛋白或小部分变体微小结构变化的检测灵敏度下降,导致采用这些生物物理学技术对双抗提供的额外表征有限。但仍应尽可能采用多种正交方法对双抗的高级结构进行表征,以便从多角度了解蛋白质高级结构,这对发生可能影响产品安全、有效性的药学变更时,如何证明产品变更前后的可比性也具有益处。此外,双抗分子结构较为复杂,氨基酸序列测定时,部分双抗的氨基酸覆盖率可能达不到100%,建议尽可能采用多种酶切形式结合肽图提高序列覆盖率。
2.3 产品相关杂质/有关物质
双抗产品相关杂质/有关物质可能包括分子大小变异体、电荷异构体、序列变异体、错配抗体、半抗体、糖化变体、氧化变体、天冬氨酸异构化等。对于分子大小变异体、电荷异构体等含量较多产品相关杂质/有关物质可采用色谱法富集,对于序列变体等痕量变异体可通过强降解方法制备,开展进一步的质量研究,分析对活性的影响。
部分双抗开发研究时出现序列变异体,已知治疗性抗体恒定区的异型变异体可在异型错配患者中引发免疫原性反应,但与临床影响无关[11]。开发者应从DNA水平、蛋白水平研究序列变体的来源、不同代次细胞中的含量,并对序列变体进行鉴别,结合已有的非临床、临床研究鉴定该变异体对安全性、有效性、免疫原性不会产生影响。若与基因突变有关,应严格控制细胞限传代次,必要时在质量标准中拟定合理的限度。
双抗因二硫键偏多,可能会出现二硫键错配结构,另外如果抗体轻链和重链可变区中存在游离巯基,可能会影响其生物活性,导致生物学活性降低[12],应在研究时采用合适的方法(如非还原变性-酶切肽图结合纯度方法)表征二硫键配对方式、游离巯基含量等,鉴定二硫键已正确配对。
考虑到抗CD3或抗Fc受体的同源二聚体可能会导致细胞因子的释放,而后者又是双抗类产品常见的安全性风险,应对同源二聚体进行定量分析,这对于与效应细胞结合的双抗十分重要。此外,新的结构可能会导致增加免疫原性[7]。
部分双抗互补性决定区(complementarity determining region,CDR)存在一定的氧化、脱酰胺、异构化、糖基化等,考虑到CDR区影响样品的有效性,增加免疫原性风险,CHUNG等[13]报道,聚糖结构α1-3连接半乳糖和N-羟乙酰神经氨酸(N-glycolylneuraminic acid,NGNA)可能参与不良免疫反应,应明确具体位点、含量,分析对活性、药代、安全性及免疫原性等的影响,制定合理的控制措施。
2.4 生物学活性
由于双抗的作用机理多样,如细胞连接、受体桥接失活、受体桥接激活、双靶点同时作用、双靶点顺序作用等,因此双抗分子开发时,除抗原结合试验、细胞表面配体结合试验、效应器功能测定外,还应尽可能开发反映双抗2个靶标结合/协同效应的生物学活性测定方法(mechanisms of action,MOA)。完善的生物测定法对于生物制品的表征和控制以及临床研究结果的解释至关重要,要求具有较好的准确性和重现性,充分体现分子作用机制,最好使用单一检测形式满足检测所需性能(即捕获分子的双重活性和潜在的协同效应),以及检测多方面的结构变化[14]。
根据分子的作用机制,除应测定主要生物学活性外,还需考虑开发多种免疫学方法,如细胞杀伤、细胞因子分泌、抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)、抗体依赖性细胞介导的吞噬作用(antibody dependent cellular phagocytosis,ADCP)等,对产品进行表征。REGISTER等[15]汇总了目前双抗生物学检测常用方法,通过案例分析结合检测、MOA、功能检测(其他支持MOA表征方法)、效应器功能检测、杂质生物测定等表征方法,为不同类型双特异性分子的生物测定开发提供策略。
目前部分企业仅开发分子水平的生物学活性检测方法,未开发细胞水平的活性研究方法。一方面与方法开发难度有关,据文献报道[16],开发稳健且适合质量控制(Quality Control,QC)的基于细胞的生物检测方法比开发非基于细胞的结合检测方法更具挑战性,细胞水平检测方法方法变异度大;另一方面,生物测定的开发、执行、转移和维护成本很高。FDA曾在2023年8月发表了针对三阴性乳腺癌双抗的研究,比较了2种不同形式双抗的生物学活性。一种具有2个针对每种抗原的结合位点的双可变结构域免疫球蛋白(dual variable domain-Ig,DVD-Ig),另一种针对每种抗原具有1个结合位点的杆臼结构(knobin-hole,KIH)。研究发现,用于分析的细胞类型(MDA-MB-231和BT-20细胞)以及抗肿瘤活性的测定会影响检测能力,如一种分析法(细胞活力)可检测2种细胞系的抗肿瘤作用,但另一种分析法(台盼蓝细胞增殖)不够灵敏,无法检测BT-20细胞的抗肿瘤作用[17]。因此进行双抗的生物学活性研究时,开发合适的细胞系以及灵敏的检测方法非常重要。
2.5 不溶性微粒(sub-visible particle,Sv P)问题
目前开发的双抗产品浓度均较高,可能会引发Sv P升高。Sv P形成原因很多,包括分子的固有特性、处方、制剂工艺及贮存/稳定性等均可影响Sv P,分析方法也会影响Sv P检测结果的可靠性。
已知可逆的蛋白质-蛋白质(自缔合)相互作用会导致光散射增加,可能会影响聚集和乳光度[18],观察到澄清度/乳光度升高。蛋白质聚集,尤其是在高浓度时,可能会导致制剂中的Sv P计数升高。SIMLER等[19]报告了蛋白质聚集与Sv P形成之间的机制途径。抗体处方中常添加聚山梨酯80或聚山梨酯20保护蛋白质免受搅拌强制降解,已知聚山梨酯20降解可能因形成不溶性游离脂肪酸(free fatty acid,FFA)微粒导致Sv P[20]。抗体制剂工艺多存在搅拌、冻融环节,可能会影响Sv P形成。有研究报道,抗体冻融时蛋白质的疏水基团和亲水基团会发生一定程度上的反转,液体中的气泡在冻融过程中可能会溶解和逸出,导致蛋白质结构的变化,易于聚集形成Sv P[21,22],此时需结合冻融研究、运输稳定性研究证实。根据《美国药典》<787>、《欧洲药典》2.9.19和《中国药典》三部(2020版)通则0903要求,推荐采用光阻法、显微计数法检查Sv P,如果光阻法测定结果不符合规定或供试品不适于用光阻法测定时,应采用显微计数法进行测定,并以显微计数法测定结果作为判定依据。对于滴眼液,应按照《美国药典》<789>规定,限度更严。两种分析方法的变异性可能会影响观察到的Sv P水平。
针对抗体药物储存时出现Sv P,应采用多种分析方法,如显微镜、FTIR光谱、拉曼光谱、Energy Dispersive X-Ray Spectroscopy(EDX光谱)、流动成像等,尽可能对Sv P进行鉴别,分析Sv P的组成,形成原因,是否随储存时间而增加等,进行必要的安全性评估,并采用合理的控制策略进行控制(如使用前过滤、替换为纯度更高的辅料等),原则上应符合现行药典及同类品种的要求。
3、 结语
随着双抗平台技术的发展,双抗药物免疫原性和链错配问题等逐渐被克服,贝林妥欧单抗、艾美赛珠单抗等10余个双抗药物已在全球获批上市,用于治疗癌症、血液系统、眼科、免疫系统疾病等。双抗药物的开发仍在快速发展中,是当下制药行业最热门的新药研发方向之一,国内外药企研发速度正在逐渐缩短差距。本文基于对多个双抗品种的审评经验,结合文献调研等对双抗药物的国内外注册申报现状进行了分析,并汇总探讨了双抗审评中常见的技术问题,以期通过研发生产方与监管方共同努力,强化技术和共性问题交流,为患者提供安全有效、质量可控的新型双抗药物。
参考文献
[1] NISONOFF A,WISSLER F C,LIPMAN L N. Properties of the major component of a peptic digest of rabbit antibody[J]. Science,1960,132(3441):1770-1771.
[2] LABRIJN A F,JANMAAT M L,REICHERT J M,et al. Bispecific antibodies:a mechanistic review of the pipeline[J]. Nat Rev Drug Discov,2019,18(8):585-608.
[3] LAN H R,CHEN M,YAO S Y,et al. Bispecific antibodies revolutionizing breast cancer treatment:a comprehensive overview [J]. Front Immunol,2023,14:1266450. DOI:10.3389/fimu.2023.1266450.
[4] HEIER J S,KHANANI A M,QUEZADA RUIZ C,et al. Efficacy,durability,and safety of intravitreal faricimab up to every 16 weeks for neovascular age-related macular degeneration(TENAYA and LUCERNE):two randomised,double-masked,phase 3,noninferiority trials[J]. Lancet,2022,399(10326):729-740.
[5] Clinical Trials. Comparing the efficacy and safety of intra-peritoneal infusion of catumaxomab and treatment of investigator choice in patients with advanced gastric carcinoma with peritoneal metastasis(uncompleted)[EB/OL].(2020-01-09)[2024-01-20]. https://classic.clinicaltrials. gov/ct2/show/NCT0422-2114?term=04222114&draw=2&rank=1.
[6] 国家药品监督管理局. 国家药监局附条件批准卡度尼利单抗注射液上市[EB/OL].(2022-06-29)[2024-01-20]. https://www.nmpa.gov.cn/directory/web/nmpa////////zhuanti/zt2023/ypgzhlfzh/shypqxgg/ggjzcx/0220629135936153.html.
[7] U. S. Food and Drug Administration. Bispecific antibody development programs guidance for industry[EB/OL].(2021-05)[2024-01-20]. https://www.fda.gov/regulatory-information/searchfda-guidance-documents/bispecific-antibody-development-programs-guidance-industry.
[8] DATTA-MANNAN A,CROY J E,SCHIRTZINGER L,et al.Aberrant bispecific antibody pharmacokinetics linked to liver sinusoidal endothelium clearance mechanism in cynomolgus mon -keys[J]. MAbs Internet,2016,8(5):969-982.
[9] GERA N. The evolution of bispecific antibodies[J]. Expert Opin Biol Ther,2022,22(8):945-949.
[10] SAMPEI Z,IGAWAT,SOEDA T,et al. Identification and multidimensional optimization of an asymmetric bispecific igg antibody mimicking the function of factor viii cofactor activity[J].PLoS One,2013,8(2):e57479. DOI:10.1371/journal.pone.0057479.
[11] WEBSTER C,BRYSON C,CLOAKE E,et al. A comparison of the ability of the human IgG1 allotypes G1m3 and G1m1,17 to stimulate T cell responses from allotype matched and mismatched donors[J]. MAbs,2016,8(2):253-263.
[12] HARRIS R J. Heterogeneity of recombinant antibodies:linking structure to function[J]. Dev Biol(Basel),2005,122:117-127.
[13] CHUNG C H,MIRAKHUR B,CHAN E,et al. Cetuximab-induced anaphylaxis and IgE specific for galactose-alpha-1,3-galactose [J]. N Engl J Med,2008,358:1109-1117.
[14] LEE H Y,SCHAEFER G,LESACA I,et al. "Two-in-One" approach for bioassay selection for dual specificity antibodies[J]. JImmunol Methods,2017,448:74-79.
[15] REGISTER A C,TARIGHAT S S,LEE H Y. Bioassay development for bispecific antibodies-challenges and opportunities[J].Int J Mol Sci,2021,22(10):5350.
[16] KARLSSON R,FRIDH V,FROSTELL Å. Surrogate potency assays:Comparison of binding profiles complements dose respo-nse curves for unambiguous ssessment of relative potencies[J]. JPharm Anal,2018,8(2):138-146.
[17] U. S. Food and Drug Administration. Bispecific antibodies:an area of research and clinical applications[EB/OL].(2023-08-02)[2024-01-20]. https://www.fda.gov/drugs/news-eventshuman-drugs/bispecific-antibodies-area-research-and-clinicalapplications.
[18] KOEPF E,SCHROEDER R,BREZESINSKI G,et al. The missing piece in the puzzle:Prediction of aggregation via the proteinprotein interaction parameter A(∗)(2)[J]. Eur J Pharm Biopharm,2018,128:200-209.
[19] SIMLER B R,HUI G,DAHL J E,et al. Mechanistic complexity of subvisible particle formation:links to protein aggregation are highly specific[J]. J Pharm Sci,2012,101(11):4140-4154.
[20] JIAO N,BARNETT G V,CHRISTIAN T R,et al. Characterization of subvisible particles in biotherapeutic prefilled syringes:the role of polysorbate and protein on the formation of silicone oil and protein subvisible particles after drop shock[J]. J Pharm Sci,2020,109(1):640-645.
[21] CHANG B S,KENDRICK B S,CARPENTER J F. Surface-induced denaturation of proteins during freezing and its inhibition by surfactants[J]. J Pharm Sci,1996,85(12):1325-1330.
[22] LIU L,QI W,SCHWARTZ D K,et al. The effects of excipients on protein aggregation during agitation:an interfacial shear rheology study[J]. J Pharm Sci,2013,102(8):2460-2470.

来源:中国生物制品学杂志2024年


