您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-13 12:02
本文适用于与不同类型放射治疗及定位设备(例如伽玛射束远距离治疗机、医用电子加速器、放射治疗模拟系统、放射治疗CT模拟机、放射治疗MRI模拟机等)配套使用,用于在患者皮肤上、患者固定装置及立体定向框架等配准装置上投射出位置参考标记,以便放射治疗时对患者进行定位的外置激光定位设备。按现行《医疗器械分类目录》,该类产品分类编码为05-04-06,管理类别为Ⅱ类。
一、放射治疗激光定位设备的工作原理与结构组成
1、工作原理
激光定位设备采用右手直角坐标系,使用不高于2M类的激光器件,可投射出线宽不大于1mm的清晰、明亮的红色、绿色或蓝色激光线。
移动式激光定位设备:安装在X、Y、Z方位的激光灯组通过手动或者遥控调节,可分别投射出相互垂直共面的矢状面、冠状面和横断面激光线,控制装置按照模拟定位系统确定的摆位坐标驱动激光灯组移动到定位点,并在患者体表两侧及上表面显示出“十”字标记点,以便放射治疗时对患者病灶进行定位。
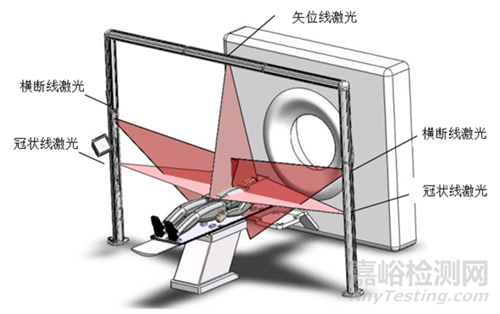
图1 移动式激光灯投射示意图
固定式激光定位设备:固定式激光定位设备主要安装在放射治疗室,在X、Y、Z方位的激光灯可分别投射出相互垂直共面的矢状面、冠状面和横断面激光线,各线的交点与放射治疗设备的等中心点完全重合,进行患者摆位时,在患者体表两侧及上表面显示出“十”字标记点,用于放射治疗时对患者病灶进行定位。
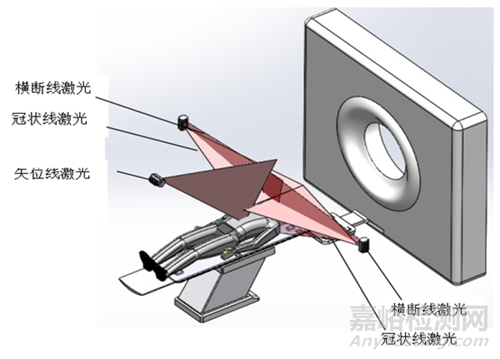
图2 固定式激光灯投射示意图
2、结构组成
激光定位设备通常由电源模块、多个固定式或移动式激光灯组件、控制装置、遥控器(如有)、软件(如有)等组成。
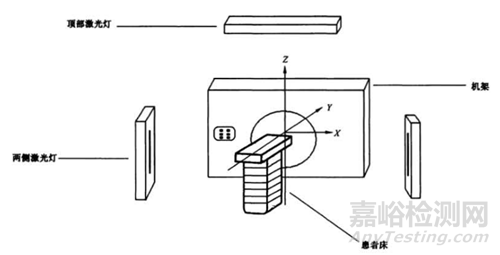
图3 激光定位设备结构示意图
注:上述示意图仅供参考,具体产品结构组成和图示应根据实际产品确定。
二、放射治疗激光定位设备的主要风险
下表所列为产品常见的可能的危险示例,需关注:
表 产品可能的危险示例
|
可能产生的危险 |
形成因素 |
||
|---|---|---|---|
|
A.能量危险 |
|||
|
电能-漏电流 (电击危害) |
保护接地阻抗,接地不良,对地阻抗大。 可触及部件与带电部分没有充分隔离。 设备的电源插头剩余电压过高。 机器外壳的防护罩封闭不良。 设备没有足够的外壳机械强度和刚度。 外部液体(清洁消毒剂)浸入设备带电部分。 上述情况的出现可造成对使用者或服务人员的电击危害。 |
||
|
电能-网电源 |
不适当的能量供应:不适当的供电电压或频率导致设备性能降低或损坏。 |
||
|
电磁能-电磁场 |
设备或部件的电磁发射对附近生命支持或非生命支持电子设备产生干扰。 |
||
|
电磁能-对电磁干扰的敏感性 |
附近电子设备或环境影响设备设备无法正常使用或定位不准确。 |
||
|
辐射能-非电离辐射 |
激光灯意外照射眼部。 |
||
|
热能-高温 |
激光的热危害,导致患者/使用者视力受损。 |
||
|
A.能量危险 |
|||
|
机械能 |
重力-坠落、悬挂 |
设备不稳定,易翻倒,砸伤患者/使用者。 悬挂部件紧固不牢,防坠装置失效。 |
|
|
运动 部件 |
运动部件极限位置限位保护装置失灵。 运动控制按键失效。 外部液体浸入运动控制按键。 运动控制按键或遥控器误触发。 运动超程。 |
||
|
其他 机械力 |
如设计、加工不当,有尖角、锐边、毛刺,对使用者和患者易造成划伤、刮伤等。 |
||
|
患者的移动和定位 |
患者非预期移动,导致定位不准确。 |
||
|
B.生物学和化学危险 |
|||
|
再感染和/或交叉 感染 |
同操作者接触部分清洗消毒没有明确的规定,可能引起感染。 |
||
|
C.性能有关的危险 |
|||
|
不正确或不适当的输出或功能 |
电能 |
连接中断时设备可触及部分带电。 |
|
|
操作人员人为输入超限坐标值、数据录入错误 |
设备非预期运动,导致设备故障,对用户造成不便。 |
||
|
C.性能有关的危险 |
|||
|
不正确或不适当的输出或功能 |
不正确的校准、或与影像和放疗设备配准操作 |
坐标体系失准,患者定位不准确。 |
|
|
数据格式错误 |
设备无法响应。 |
||
|
功能的丧失或变坏 |
维护不良和老化引起的危害。 对医疗器械寿命的终止缺少适当的决定。应规定激光定位设备的使用寿命,特别是激光灯的寿命等。否则将产生设备老化,安全性能出现隐患等现象。 |
||
|
使用错误造成的危害、缺乏注意力、不遵守规则、缺乏常识、违反常规 |
未按规定编制产品说明书,使用说明不明确。 由不熟练/未经培训的人员使用易造成危害。
|
||
|
D. 其他方面的危险 |
|||
|
标记 |
外部和内部标记不全面、标记不足、标记不正确或不能够清楚易认,以及标记不能够永久贴牢。如:警告性说明、输入功率、电源电压、电流、频率、分类、生理效应、接地端子符号、危险电压等标记出现问题。 元器件标记不正确。 |
||
|
D. 其他方面的危险 |
|||
|
使用说明书、操作 说明书 |
没有使用说明书和技术说明书,或其内容不全、有缺失。如缺少必要的警告说明、缺少详细的使用方法、缺少必要的技术参数、缺少电路图和元器件清单、缺少运输和贮存环境条件的限制。 性能特征的不适当的描述。 不适当的预期使用规范。过于复杂的操作说明。 |
||
|
警告 |
警告不恰当。 使用激光定位设备进行定位过程中,会产生副作用,如对患者或操作者的眼睛等部位造成伤害。所以应有充分的警告。 |
||
|
服务和维护规范 |
服务和维护规范缺少或不适当,包括维护后功能性检查规范的不适当。 说明书中应包含维护、保养等内容。如:清洗、预防性检查、保养以及保养周期。 说明书中应提供电路图、元器件清单、校正细则等可供技术人员修理的必须的资料。 技术人员在维修后应对设备进行功能性检查,达到相关要求后是设备再投入使用,否则将带来危害。 |
||
|
锐边或锐尖角 |
如设计、加工不当,有锐边或锐尖角,对使用者和患者可造成划伤的危害。 |
||
|
其他 |
设备停电后又恢复时可造成危险。 设备的内部结构和布线不当。 设备不能防止有害进液。 |
||
|
储存或运行偏离预定的环境条件 |
设备本身不能满足规定的环境条件要求或工作环境得不到满足,导致设备不能够正常运行。 |
||
三、放射治疗激光定位设备性能研究实验要求
1、产品性能研究
1.1应当明确产品物理和/或机械性能指标的确定依据、设计输入来源以及临床意义,所采用的标准或方法、采用的原因及理论基础。
1.2开发人应结合产品工作原理及适用范围,明确申报产品结构组成或各主要元器件功能性指标并开展详细的研究,例如电源模块功能、遥控器控制功能、数据传输的研究、电机选型及其性能的验证等。
2、电气系统安全性研究
应当开展电气安全性、机械和环境保护以及电磁兼容性的研究。
目前与本产品相关的标准包括:GB 9706.1《医用电气设备第1部分:基本安全和基本性能的通用要求》,YY 9706.102《医用电气设备第1-2部分:基本安全和基本性能的通用要求并列标准:电磁兼容要求和试验》和GB 7247.1《激光产品的安全第1部分:设备分类、要求》。
3、软件研究(若适用)
参照《医疗器械软件注册审查指导原则(2022年修订版)》要求开展软件。如产品具有网络连接功能方式用以进行电子数据交换、远程访问与控制或用户访问的,需参照《医疗器械网络安全注册技术审查指导原则(2022年修订版)》要求开展网络安全研究。
4、生物相容性评价研究(若适用)
对产品结构组成中与患者接触部分的生物相容性进行评价。生物相容性评价可根据GB/T 16886.1和《关于印发医疗器械生物学评价和审评指南的通知》的要求进行。生物相容性评价研究应当明确生物相容性评价的依据和方法;产品所用材料及与人体接触的性质;实施或豁免生物学试验的理由;对于现有数据或试验结果的评价。
5、清洗消毒灭菌工艺研究(若适用)
终端用户清洁和消毒:应当明确推荐的消毒工艺(方法和参数)、工艺的确定依据并开展相关验证。
6、证明产品安全性、有效性的其他研究。
根据产品的具体特性,需开展的其他研究。若产品需与磁共振配合使用,应开展适用于磁共振环境的相关研究。
7、稳定性研究
7.1使用稳定性
应依据《有源医疗器械使用期限注册技术审查指导原则》要求,开展产品使用期限分析。
应根据自身产品临床应用和产品设计情况,确定出产品的关键部件和可更换部件。应明确在预期使用条件下关键部件的使用期限,及可更换部件的定期保养维护时间和更换频次,且应明确确定使用寿命和更换频次的依据。
7.2运输稳定性
应当开展运输稳定性和包装研究,证明在生产企业规定的运输条件下,运输过程中的环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能造成不利影响,可参考GB/T 14710《医用电器环境要求及试验方法》的要求进行研究。开发人应结合声称的储运条件开展包装和环境试验研究。应在所声称的储运条件下进行性能测试,证明运输和环境测试后产品能够保持其完整性和功能性。
8.其他
申报产品属于《免于临床评价医疗器械目录》(以下简称目录)中产品,可以按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》的要求开展相关研究。应从基本原理、结构组成、性能要求、适用部位、预期用途等方面进行申报产品与《目录》中已获准境内注册医疗器械的对比。若经对比,存在其他差异的,还应开展差异部分对安全有效性影响的分析研究。

来源:嘉峪检测网


