您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-19 08:36
荷兰皇家飞利浦公司近日宣布,该公司首例 Duo 静脉支架系统被植入,这是一种植入式医疗设备,用于治疗慢性静脉功能不全(CVI)患者的症状性静脉流出道阻塞,该设备已获得美国食品药品管理局(FDA)的上市前批准(PMA)。
著名 Atrium Health 桑格心脏与血管研究所血管外科医生兼静脉与淋巴项目主任、VIVID 研究研究员(该研究促成了该设备获得 FDA 批准)艾琳·墨菲(Erin Murphy,美国夏洛特)首次在临床试验之外成功使用了 Duo 静脉支架系统。
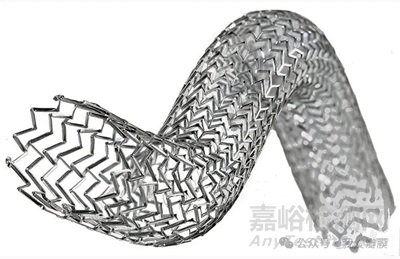
Duo 静脉支架系统专为满足静脉解剖和阻塞的独特需求而设计,由两个不同尺寸的支架(Duo Hybrid 和 Duo Extend)组成。Duo Hybrid 具有独特的集成设计,将多个具有不同机械性能的区域组合成一个支架。对于长病变,Duo Extend 可与 Duo Hybrid 顺利重叠以延长治疗时间。这两个支架旨在协同工作,最大限度地降低支架断裂和腐蚀的风险,同时提供在直径较小的尾静脉内放置支架的选择。
介入放射科医生、西北大学放射学、外科和医学副教授库什·德赛 (Kush Desai)(美国芝加哥)表示:“Duo 是首个针对静脉解剖挑战提供差异化设计的支架——既能承受压缩力,又能灵活适应血管弯曲。”他也是 VIVID 研究的主要招募者和研究员。飞利浦通过提供包括血管内超声和差异化静脉支架系统在内的强大医疗技术组合,完全有能力支持 CVI 治疗。”
VIVID 研究
VIVID 研究是一项全球性、前瞻性、多中心、单组、非盲临床试验,在美国和波兰进行,旨在评估飞利浦双静脉支架系统在治疗非恶性髂股静脉闭塞性疾病方面的安全性和有效性。该研究在 30 个中心招募了 162 名受试者,分为三类患者——非血栓性髂静脉病变 (NIVL)、血栓后综合征 (PTS) 和急性深静脉血栓形成 (aDVT)。VIVID 研究目前处于 36 个月的随访期,在获得 FDA PMA 批准后,该研究从试验性器械豁免 (IDE) 研究转变为上市后研究 (PAS):NCT04580160。

VIVID 研究满足了其所有主要的安全性和有效性性能目标。
12 个月的初级通畅率有效终点达到 90.2%,超过了 77.3% 的绩效目标。
12 个月主要安全终点为 98.7%,也超过了相应的 89% 的绩效目标。
此外,VIVID 研究中执行的生活质量和静脉功能评估(包括临床病因解剖病理生理 (CEAP)、静脉临床严重程度评分 (VCSS)、Villalta、EQ-5D-3L 和 VEINES 评分)与 12 个月时的基线相比显示出持续改善。
首席研究员 Mahmood Razavi 博士(美国奥兰治县)表示:“VIVID 研究的 12 个月结果证明了 Duo 静脉支架系统在治疗慢性静脉功能不全方面的安全性和有效性,慢性静脉功能不全是一种影响全球数百万人的血管疾病。Duo 为临床医生治疗 CVI 患者提供了有意义的补充工具,尤其是与血管内超声 (IVUS) 结合使用时。最终,这款新设备有望实现出色的临床效果并显著改善生活质量。”
VIVID 研究是首个强制使用 IVUS 辅助评估病变和确定支架尺寸的临床试验,之后再植入装置。根据之前发表的研究,IVUS 有助于准确诊断静脉疾病,与单纯的静脉造影相比,IVUS 可改变 57% 的治疗计划。在飞利浦的领导下,超过 70% 的静脉支架手术都使用了血管内成像。
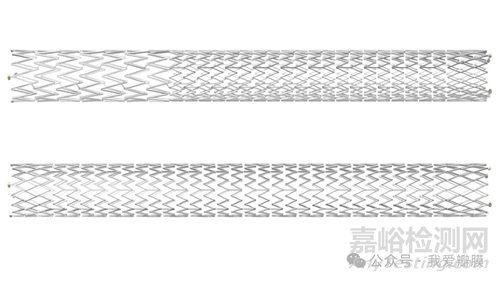
飞利浦外周血管业务副总裁兼业务负责人 Heather Hudnut Page 表示:“Duo 静脉支架系统的推出代表我们在实现利用先进医疗技术革新介入手术的愿望方面又迈出了一步。在此背景下,我们期待将血管内超声和 Duo 的综合服务带给跨学科团队——从血管外科医生到介入放射科医生和介入心脏病专家——他们与我们有着共同的首要目标,那就是加强患者护理。”

来源:我爱瓣膜


