您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-09-25 20:31
医疗器械消毒是确保患者安全和预防医疗相关感染不可或缺的关键过程。医疗器械会直接接触患者的身体或体液,如果消毒不当,它们将成为有害病原体传播的潜在媒介。因此,在医疗器械用于临床环境之前,灭菌对于消除医疗器械中的微生物(包括细菌、病毒和真菌)至关重要。
灭菌是指从表面、环境、液体或化合物中完全破坏或去除所有活微生物,包括其孢子。该过程旨在使医疗器械不含传染性病原体,从而降低患者伤害和交叉污染的风险。
医疗器械制造商采用各种灭菌方法,每种方法都有其优点、局限性以及与不同类型的医疗器械的兼容性。常见的灭菌方法包括蒸汽灭菌(高压灭菌)、环氧乙烷(EO)灭菌、辐射灭菌(伽马、电子束)和低温灭菌方法,如双氧水气体等离子体和汽化过氧化氢。
灭菌方法的选择取决于医疗器械的类型、材料成分、复杂性以及与特定灭菌工艺的兼容性等因素。制造商、NB机构通力合作,确保医疗器械得到有效灭菌,同时保持其功能和完整性。
除了选择适当的灭菌方法外,遵守有关医疗器械灭菌的既定标准、法规和指南也至关重要。这些标准,如ISO 13485(医疗器械质量管理体系)和ISO 11135(环氧乙烷灭菌),为灭菌过程的开发、验证和常规控制提供了全面的要求。
此外,灭菌过程的验证对于证明所选方法在实现微生物杀灭方面的有效性和一致性至关重要。验证包括进行严格的测试,以确认灭菌过程在不影响设备性能或安全性的情况下始终如一地达到所需的微生物减少水平。
医疗器械的各种灭菌方法图1:医疗器械的各种灭菌方法
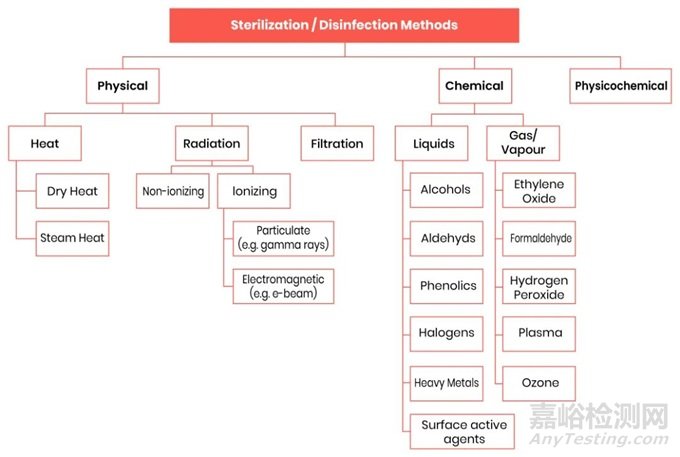
一些常见的法规要求和支持标准的概述:
由于医疗器械在患者护理中的关键性质,因此对医疗器械灭菌的监管要求非常严格。法规和标准因国家或地区而异,但一些常见的要求包括:
美国FDA(食品和药物管理局):
FDA 根据联邦法规 (CFR) 第 21 条对医疗器械进行监管,其中包括质量体系法规(21 CFR 第 820 部分)。第 820 部分概述了制造过程(包括灭菌过程)的设计、验证和控制要求。
FDA提供指导文件,如“行业和FDA工作人员指南-医疗保健环境中的医疗器械后处理:验证方法和标签”和“国际标准ISO 10993-1的使用”。
欧盟:
医疗器械灭菌受医疗器械法规 (MDR) 或体外诊断医疗器械法规 (IVDR) 的监管,具体取决于器械的分类。
欧洲标准化委员会 (CEN) 和国际标准化组织 (ISO) 标准与欧盟法规相协调。对于灭菌,相关标准包括质量管理体系的 ISO 13485 和灭菌过程的验证和常规控制的 ISO 14937。
国际标准:
ISO 11135:本标准规定了医疗器械环氧乙烷灭菌过程的开发、验证和常规控制的要求。
ISO 11137:本标准规定了医疗器械辐射灭菌的开发、验证和常规控制的要求。
ISO 17665:本标准规定了医疗器械湿热灭菌过程的要求。
其他要求:
验证:必须对灭菌过程进行验证,以证明其有效性和一致性。这通常涉及执行验证研究,以确定灭菌过程的时间、温度和压力等参数。
生物相容性:医疗器械必须具有生物相容性,这意味着它们不会对患者造成伤害。这通常通过根据 ISO 10993 的生物相容性测试进行评估。
标签:制造商必须为已消毒的医疗器械提供适当的标签,包括使用说明、灭菌方法以及任何预防措施或警告。
上市后监督:制造商必须监控灭菌医疗器械投放市场后的性能,以识别和解决可能出现的任何问题。
遵守这些法规要求和标准对于制造商确保灭菌医疗器械的安全性、有效性和质量至关重要。不遵守这些要求可能会导致监管行动,包括产品召回和法律处罚。
全球公认的一些关键标准:
多项标准管理医疗器械的灭菌,确保其安全性和有效性。
ISO 13485:2016 – 医疗器械 – 质量管理体系 – 监管要求:
本标准规定了特定于医疗器械行业的质量管理体系的要求,包括与灭菌过程相关的要求。
ISO 11135:2014 – 保健品灭菌 – 环氧乙烷 – 医疗器械灭菌过程的开发、验证和常规控制要求:
ISO 11135 规定了医疗器械环氧乙烷灭菌过程的开发、验证和常规控制的要求。
ISO 11137-1:2015 – 保健品灭菌 – 辐射 – 第 1 部分:医疗器械灭菌过程的开发、验证和常规控制要求:本标准规定了医疗器械辐射灭菌过程的开发、验证和常规控制的要求。
ISO 17665-1:2006 – 保健品灭菌 – 湿热 – 第 1 部分:医疗器械灭菌过程的开发、验证和常规控制要求:
ISO 17665 规定了医疗器械湿热灭菌过程的开发、验证和常规控制的要求。
ISO 14937:2009 – 保健品灭菌 – 灭菌剂表征以及医疗器械灭菌过程的开发、验证和常规控制的一般要求:本标准规定了灭菌剂的表征以及医疗器械灭菌过程的开发、验证和常规控制的一般要求。
ANSI/AAMI ST79:2017 – 医疗机构蒸汽灭菌和无菌保证综合指南:本美国国家标准为医疗机构中的蒸汽灭菌和无菌保证提供了指导,包括流程、监测和文档。
ANSI/AAMI/ISO 11137-2:2013 – 保健品灭菌 – 辐射 – 第 2 部分:确定灭菌剂量:
本标准规定了使用辐射的医疗器械的灭菌剂量(灭菌所需的辐射量)的确定方法。
ANSI/AAMI/ISO 17665-1:2006 – 保健品灭菌 – 湿热 – 第 1 部分:医疗器械灭菌过程的开发、验证和常规控制要求:该标准采用 ISO,规定了医疗器械湿热灭菌过程的开发、验证和常规控制的要求。
这些标准为各种灭菌方法提供了指南和要求,包括环氧乙烷、辐射和湿热。它们涵盖了从开发和验证到日常控制和监测的整个灭菌过程,确保医疗器械得到有效灭菌并安全地用于医疗环境。

来源:欧杰MDR认证


