您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-10-05 21:01
1、毛细管电泳技术简介
1.1 定义:
毛细管电泳(Capillary Electrophoresis, CE),也可以称之为高效毛细管电泳(HPCE),是利用毛细管为被测物的分离场所,高压直流电场为被测物驱动力,根据样品间组分淌度和它们之间分配行为的不同,从而使其得到分离的一种液相分离技术,是将传统电泳技术与现代微柱分离技术结合起来,在20世纪80年代迅速发展起来的又一可以同气相色谱和高效液相色谱相提并论的分离分析技术。
仪器结构组成:高压电源、毛细管柱、缓冲液池、进样系统、检测器以及数据处理系统等。
分离原理:利用毛细管为被测物的分离场所,高压直流电场为被测物驱动力,根据样品间组分淌度和它们之间分配行为的不同,从而使其得到分离。
1.2 特点:
毛细管电泳通常使用内径为25-100 μm 的弹性(聚酰亚胺)涂层熔融石英管。标准毛细管的外径为375 μm,有些管的外径为160 μm。毛细管的特点是:容积小(一根100 cm×75 μm 管子的容积仅4.4 μL);侧面/截面积比大,因而散热快、可承受高电场(100-1000 V/cm);可使用自由溶液、凝胶等为支持介质;在溶液介质下能产生平面形状的电渗流。
由此,可使毛细管电泳具备如下优点:
(1)高效塔板数目在105-106片/m间,当采用CGE时毛细管电泳色谱图,塔板数目可达107片/m以上;
(2)快速一般在十几分钟内完成分离;
(3)微量进样所需的样品体积为nL级;
(4)多模式可根据需要选用不同的分离模式且仅需一台仪器;
(5)经济实验消耗不过几毫升缓冲溶液,维持费用很低;
(6)自动CE是目前自动化程度较高的分离方法。
毛细管电泳的缺点是:
(1)由于进样量少,因而制备能力差;
(2)由于毛细管直径小,使光路太短,用一些检测方法(如紫外吸收光谱法)时,灵敏度较低;
(3)电渗会因样品组成而变化,进而影响分离重现性。
1.3 仪器系统
毛细管电泳系统的基本结构包括进样系统、两个缓冲液槽、高压电源、检测器、控制系统和数据处理系统。
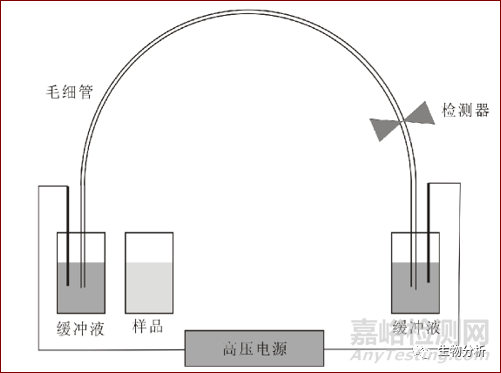
图1 毛细管电泳装置示意图
由于毛细管内径的限制,检测信号是CE系统最突出的问题,CE常用检测器:
(1)UV: 常用,但易受到仪器、单波长等因素的限制;
(2)二极管阵列(PDA)检测器:应用最广泛;
(3)激光光热(LIP):常规高敏;
(4)荧光(FL)检测器:常规高敏;
(5)激光诱导荧光(LIF):近年新产生
(6)安培(EC):选择性良好
(7)电导(CD):通用性很好
(8)质谱(MS):通用性很好,可以获得结构信息
除了电感耦合等离子体(ICP)和红外(IR)技术没有和CE联用,其他的检测方法均和CE联用并且大部分实现商品化。
使用CE时应该根据所分析物质的特点,选择相应分离模式和检测器,以扬长避短,得到最佳分析效果。
毛细管电泳仪的主要部件和其性能要求如下。
(1)毛细管用弹性石英毛细管,内径50μm和75μm两种使用较多(毛细管电色谱有时用内径再大些的毛细管)。细内径分离效果好,且焦耳热小,允许施加较高电压,但若采用柱上检测因光程较短检测限比较粗内径管要差。毛细管长度称为总长度,根据分离度的要求,可选用20~100cm长度,进样端至检测器间的长度称为有效长度。毛细管常盘放在管架上控制在一定温度下操作,以控制焦耳热,操作缓冲液的黏度和电导度,对测定的重复性很重要。
(2)直流高压电源采用0~30kV(或相近)可调节直流电源,可供应约300μA电流,具有稳压和稳流两种方式可供选择。
(3)电极和电极槽两个电极槽里放入操作缓冲液,分别插入毛细管的进口端与出口端以及铂电极,铂电极接至直流高压电源,正负极可切换。多种型号的仪器将样品瓶同时用做电极槽。
(4)冲洗进样系统每次进样之前毛细管要用不同溶液冲洗,选用自动冲洗进样仪器较为方便。进样方法有压力(加压)进样、负压(减压)进样、虹吸进样和电动(电迁移)进样等。进样时通过控制压力或电压及时间来控制进样量。
(5)检测系统紫外-可见光分光检测、激光诱导荧光检测、电化学检测和质谱检测均可用作毛细管电泳的检测器。
其中以紫外-可见光分光光度检测器应用最广,包括单波长、程序波长和二极管阵列检测器。将毛细管接近出口端的外层聚合物剥去约2mm一段,使石英管壁裸露,毛细管两侧各放置一个石英聚光球,使光源聚焦在毛细管上,透过毛细管到达光电池。对无光吸收(或荧光)的溶质的检测,还可采用间接测定法,即在操作缓冲液中加入对光有吸收(或荧光)的添加剂,在溶质到达检测窗口时出现反方向的峰。
(6)数据处理系统与一般色谱数据处理系统基本相同。
1.4 影响分离的因素
1.4.1 缓冲液
缓冲试剂的选择主要由所需的pH决定,在相同的pH下,不同缓冲试剂的分离效果不尽相同,有的可能相差甚远。
CE中常用的缓冲试剂有:磷酸盐、硼砂或硼酸、醋酸盐等。
缓冲盐的浓度直接影响到电泳介质的离子强度,从而影响Zeta电势,而Zeta电势的变化又会影响到电渗流。缓冲液浓度升高,离子强度增加,双电层厚度减小,Zeta电势降低,电渗流减小,样品在毛细管中停留时间变长,有利于迁移时间短的组分的分离,分析效率提高。同时,随着电解液浓度的提高,电解液的电导将大大高于样品溶液的电导而使样品在毛细管柱上产生堆积的效果,增强样品的富集现象,增加样品的容量,从而提高分析灵敏度。但是,电解液浓度太高,电流增大,由于热效应而使样品组分蜂形扩展,分离效果反而变差。此外,离子还可以通过与管壁作用以及影响溶液的粘度、介电常数等来影响电渗,离子强度过高或过低都对提高分离效率不利。
1.4.2 pH值
缓冲体系pH的选择依样品的性质和分离效率而定,是决定分离成败的一大关键。不同样品需要不同的pH分离条件,控制缓冲体系的pH值,一般只能改变电渗流的大小。pH能影响样品的解离能力,样品在极性强的介质中离解度增大,电泳速度也随之增大,从而影响分离选择性和分离灵敏度。pH还会影响毛细管内壁硅醇基的质子化程度和溶质的化学稳定性,pH在4-10之间,硅醇基的解离度随pH的升高而升高,电渗流也随之升高。因此,pH为分离条件优化时不可忽视的因素。
1.4.3 分离电压
在CE中,分离电压也是控制电渗的一个重要参数。高电压是实现CE快速、高效的前提,电压升高,样品的迁移加大,分析时间缩短,但毛细管中焦耳热增大,基线稳定性降低,灵敏度降低;分离电压越低,分离效果越好,分析时间延长,峰形变宽,导致分离效率降低。因此,相对较高的分离电压会提高分离度和缩短分析时间,但电压过高又会使谱带变宽而降低分离效率。电解质浓度相同时,非水介质中的电流值和焦耳热均比水相介质中小得多,因而在非水介质中允许使用更高的分离电压。
1.4.4 温度
温度影响分离重现性和分离效率,控制温度可以调控电渗流的大小。温度升高,缓冲液粘度降低,管壁硅轻基解离能力增强,电渗速度变大,分析时间减短,分析效率提高。但温度过高,会引起毛细管柱内径向温差增大,焦耳热效应增强,柱效降低,分离效率也会降低。
1.4.5 添加剂
在电解质溶液中加入添加剂,例如中性盐、两性离子、表面毛细管活性剂以及有机溶剂等,会引起电渗流的显著变化。表面活性剂常用作电渗流的改性剂,通过改变浓度来控制电渗流的大小和方向,但当表面活性剂的浓度高于临界胶束浓度时,将形成胶束。加入有机溶剂会降低离子强度,Zeta电势增大,溶液粘度降低,改变管壁内表面电荷分布,使电渗流降低。在电泳分析中,缓冲液一般用水配制,但用水一有机混合溶剂常常能有效改善分离度或分离选择性。
1.4.6 进样
CE的常规进样方式有两种:流体力学和电迁移进样。
电迁移进样是在电场作用下,依靠样品离子的电迁移和(或)电渗流将样品注入,故会产生电歧视现象,会降低分析的准确性和可靠性,但此法尤其适用于粘度大的缓冲液和CGE情况。
流体力学进样是普适方法,可以通过虹吸、在进样端加压或检测器端抽空等方法来实现,但选择性差,样品及其背景同时被引入毛细管,对后续分离可能产生影响。通过进样时间也可以来改善分离效果,进样时间过短,峰面积太小,分析误差大。进样时间过大,样品超载,进样区带扩散,会引起峰之间的重叠,与提高分离电压一样,分离效果变差。
另外,毛细管电泳技术的高分离性能以及消耗试剂少等特点使其分析领域得到了广泛的应用,但是其常规分析的灵敏度不能适应痕量分析的要求,限制了它的应用和推广。样品前处理技术可以提高样品通量或将痕量分析物进行预富集,去除样品基质,将其与毛细管电泳技术联用不仅可以提高分析的灵敏度,同时也消除了大部分可能的基质干扰,是一种比较理想的富集分离检测技术。
常用的有CE-流动注射联用技术、固相萃取-CE联用技术、固相微萃取-CE联用技术、液相微萃取-CE联用技术、微透析-CE联用技术和膜萃取-CE联用技术。
当前毛细管电泳技术主要以提高CE的定量准确性,提高分离效率和扩大应用范围为目的,故CE技术研究主要围绕新的CE技术(进样手段和分离模式)、涂层技术、涂层材料、在线富集技术、检测技术和新的联用接口技术(CE-MS、CE-MicroTAS)而展开。
1.5 毛细管电泳应用
CE具有多种分离模式(多种分离介质和原理),故具有多种功能,因此其应用十分广泛,通常能配成溶液或悬浮溶液的样品(除挥发性和不溶物外)均能用CE进行分离和分析,小到无机离子,大到生物大分子和超分子,甚至整个细胞都可进行分离检测。它广泛应用于生命科学、医药科学、临床医学、分子生物学、法庭与侦破鉴定、化学、环境、海关、农学、生产过程监控、产品质检以及单细胞和单分子分析等领域。
目前,CE分析技术被药物分析工作者在药品检验领域迅速推广应用。药物分析大致可以分为两部分:一、原药的定量、原药中杂质的测定、药剂分析以及对它们稳定性的评价等以药品质量管理为目的的测定方法。这些方法要求有良好的选择性、适当的分析灵敏度和可靠的准确度等;二、对进入人体内的药物或代谢物的吸收、分布、代谢、排泄等体内动态的研究,即临床药物分析。这两部分的测定一般需要分离和检测手段相结合。
2、 毛细管电泳分类
2.1 按毛细管电泳分离模式分类
CE众多的分离模式是其应用广泛的基础,在进行样品分离时通常需要根据分离目的来选择合适的分离模式,以达到最佳的分离效果。
常见的CE分离模式有毛细管区带电泳(CZE)、胶束电动毛细管电泳(MEKC),毛细管等电聚焦(CIEF)、毛细管凝胶电泳(CGE)、毛细管等速电泳(CITP)和毛细管电色谱(CEC)。CE可以按操作方式分为手动、半自动和全自动三种类型,或按分离通道形状分为圆形、扁形、方形毛细管,也可以按表1所示方式进行分类[15,32,33]。
表2 毛细管电泳分类
|
类型 |
缩写 |
说明 |
原理 |
|
|
1 单根毛细管 |
毛细管区带电泳 |
CZE |
毛细管和电极槽灌有相同的缓冲液 |
离子电泳淌度差异 |
|
毛细管等速电泳 |
CITP |
使用两种不同的CZE 缓冲液 |
组分淌度差异 |
|
|
毛细管等电聚焦 |
CIEF |
管内装pH 梯度介质,相当于pH 梯度CZE |
等电点差异 |
|
|
胶束电动毛细管色谱 |
MEKC |
在CZE 缓冲液中加入一种或多种胶束 |
疏水性/离子性差异 |
|
|
微乳液毛细管电动色谱 |
MEEKC |
在CZE 缓冲液加入水包油乳液高分子离子交换 |
疏水性/离子性差异 |
|
|
毛细管电动色谱 |
PICEC |
在CZE 缓冲液中加入可微观分相的高分子离子 |
疏水性/离子性差异 |
|
|
开管毛细管电色谱 |
OTCEC |
使用固定相涂层毛细管,分正、反相于离子交换 |
视涂层性质而定 |
|
|
亲和毛细管电泳 |
ACE |
在CZE 缓冲液或管内加入亲和作用试剂 |
视亲和试剂而定 |
|
|
非胶毛细管电泳 |
NGCE |
在CZE 缓冲液中加入高分子构成筛分网络 |
视高分子性质而定 |
|
|
2 单根填充管 |
毛细管凝胶电泳 |
CGE |
管内填充凝胶介质,用CZE 缓冲液 |
溶质分子尺寸与电荷/质量比差异 |
|
聚丙烯酰胺毛细管凝胶电泳 |
PA-CGE |
管内填充聚丙烯酰胺凝胶 |
电荷/分子大小差异 |
|
|
琼脂糖毛细管凝胶电泳 |
Agar-CGE |
管内填充琼脂糖凝胶 |
离子交换/氢键差异 |
|
|
填充毛细管电色谱 |
PCCEC |
毛细管内填充色谱填料,分正、反相于离子交换等 |
色谱原理 |
|
|
3 |
阵列毛细管电泳 |
CAE |
利用一根以上的毛细管进行CE 操作 |
|
|
4 |
芯片式毛细管电泳 |
CCE |
利用刻制在载玻片上的毛细通道进行电泳 |
|
|
5 联用 |
毛细管电泳/质谱 |
CE/MS |
常用电喷雾接口,需挥发性缓冲液 |
|
|
毛细管电泳/核磁共振 |
CE/NMR |
需采用停顿式扫描样品峰的测定方法 |
||
|
毛细管电泳/激光诱导荧光 |
CE/LIF |
具单细胞、单分子分析潜力 |
2.2 按操作方式分类
毛细管电泳仪可以按操作方式重新分为手动、半自动及全自动型毛细管电泳。
2.3 按分离通道形状分类
按分离通道形状分为圆形、扁形、方形毛细管电泳等。
2.4 按缓冲液的介质分类
根据配制缓冲液的介质的不同,可以把CE分为水相毛细管电泳和非水毛细管电泳(NACE)。NACE是以有机溶剂作介质的电泳缓冲液代替以水为介质的缓冲溶液,增加了疏水性物质的溶解度,特别适用于在水溶液中难溶而不能用CE分离的物质或在水溶液中性质相似难以分离的同系物,拓宽了CE的分析领域。
参考来源:
[1]《毛细管电泳技术及应用(第三版)》,陈义著,化学化工出版社
[2] 毛细管电泳_百度百科 (baidu.com)

来源:Internet


