您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-21 08:32
本文案例节选自Pharmaceutical Equivalence by Design for Generic Drugs: Modified-Release Products一文,这3个案例表明了在仿制缓释制剂设计中的注意事项,值得思考。
摘要:美国CDER仿制药办公室(OGD)为确保仿制药的高质量提出了两项要求,仿制药需与参比制剂(RLD)药学等效和生物等效。这两项要求成功使得仿制药和参比制剂具有相同的治疗效果。然而随着制剂被设计的日益复杂,仿制药一致性评价的方法也应该与时俱进。质量源于设计(QBD)通过引入目标产品质量概况(QTPP)的概念提供了一个很好的方法。
这篇文章通过3个例子介绍QBD方法在当前评价缓控释制剂提高生物等效性方面的作用,采用使用适当的质量控制策略实现药学等效源于设计。
介绍
为加强和规范药品的现代化制造和产品质量,美国食品药品监督管理局(FDA)提出了21世纪药品生产质量管理规范(GMPs)和“质量源于设计(QBD)”。类似FDA的倡议,仿制药办公室也为评测仿制药(ANDAs)的化学,生产和控制(CMC)提出了“问题综述。
为了理解为什么会提出这些倡议,理解药品质量的含义,尤其是仿制药药品质量的含义就变得非常重要。Janet Woodcock(药品评估和研究中心主任)的一篇文章中写到,所谓药品质量就是药品没有污染,同时能够重复提供给消费者其说明书上写的治疗效果。仿制药和品牌药或参比制剂在治疗效果上应该相同或可以互换,意味着仿制药提供的治疗效果应该与其说明书上承诺的效果一致。
历史上,仿制药(OGD)办公室要求高质量的仿制药应同时满足两个要求:
药学等效
生物等效
药学等效性要求除其它事项以外,仿制药应与参比制剂具有相同的有效成分,相同的剂型和给药途径,相同的剂量或浓度。
另外,仿制药也要满足药典或其它一般要求,包括剂量,质量和纯度。生物等效性是指两个制剂在相同的条件下给药,药物吸收的速率和程度没有统计学差异。通过建立药学等效和生物等效,仿制药和参比制剂的治疗效果就会被认为是等效的,也就意味着按说明书使用仿制药其临床效果和安全性和参比制剂将是一致的,不需要任何调整和检测。
传统的审查方法在批准和参比制剂的治疗效果一样的高质量仿制药方面,取得了巨大的成功。然而我们也要注意到,传统的审查方法面对的一般都是设计简单的剂型,例如液体制剂和能够快速释放的口服制剂,而现在制剂设计的越来越复杂,比如缓控释制剂(口服),透皮给药制剂等复杂给药系统,随着药品越来越复杂,之前的简单方法已经不能保证仿制药和参比制剂等效。
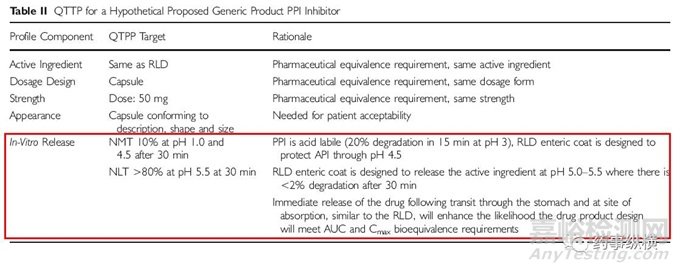
因此,面对现在越来越复杂的给药系统,对之前的方法进行完善将是非常有必要的。FDA的“QBD”和ICH Q8的目标产品质量概况(QTPP)倡议能够很好的保证药品质量。药学等效除其它要求外,还要仿制药质量符合一定的标准。QTPP在监管层面提出药学等效性源于设计。
QTPP在复杂剂型仿制药一致性评价中扮演了重要角色,因为药学等效不仅仅是意味着要与参比制剂一样含有相同的活性成分,相同的剂型,也要有相同的设计。这篇文章展示了参比制剂临床上QTPP的用处,确定其关键质量属性,并用可量化的指标来进行药学等效源于设计。
一致性评价的传统方法
仿制药的治疗效果只有和参比制剂一致,仿制药才会得到批准,也就是说仿制药的活性成分,剂型,剂量和给药途径都要与参比制剂一致,同时还要和参比制剂生物等效,简单剂型满足这些要求就可以了。但对于剂型复杂的药品,还需要一些剂型设计方面的额外信息才能实现“一致性”。下面举的例子有助于理解剂型设计在“仿制药一致性评价”中的重要性。
案例一:能影响机体吸收的缓释药物
第一个例子将介绍剂型设计的重要性,尤其是能改变或影响机体吸收的缓控释制剂,这一点特别重要,因为一般健康志愿者身上做的用于支持仿制药生物等效的单剂量实验不能揭示这个差别。虽然不是全部,但是质子泵抑制剂类(PPIs)药物能够改变机体吸收,比如奥美拉唑。
质子泵抑制剂的一个显著特点是它们在酸中不稳定,因此质子泵抑制剂类制剂一般都有肠溶包衣,从而保护它们免于被胃中的酸降解。长期使用质子泵抑制剂能够将胃环境的pH从1提高至2-7,因此改变了质子泵抑制剂自身的吸收,也影响质子泵抑制剂的治疗效果,但这一点是不能通过普通的单剂量实验能够发现的。
举个例子,如果一个PPIs仿制药的肠溶包衣在pH3的环境中才会降解,而参比制剂的肠溶包衣在pH5-6的环境中才降解。在单剂量实验中健康志愿者胃中的pH一般为1,仿制药和参比制剂是生物等效的。但是长期服用PPIs,患者胃中的pH将升高至2-7。那么胃中pH已经变为3-5的患者服用仿制药,其肠溶包衣在pH3的环境就会降解,导致制剂中的PPIs提早释放,因此被胃酸破坏,相比参比参比制剂仿制药的生物利用度变低。
事实上,有报道称美国市场以外的仿制药具有不同的肠溶包衣。Losec参比制剂的肠溶包衣被设计用来保护PPIs免于被酸降解,只有在pH值大于5时才会释放PPIs,相应的成分为HPMC的肠溶包衣在pH3的环境中就会释放药物。单剂量实验中看不出来不同肠溶包衣的产别,只有连续服用5天以后才能体现出差别。
这个例子引申出一个重要概念,就是即使仿制药和参比制剂具有相同的活性成分,相同的剂型,在健康志愿者身上做的单剂量实验也表明这两者生物等效,为确保治疗等效,也要考虑药物长期服用的影响。仿制药和参比制剂的关键制剂属性应该是一致的,具体到PPIs就是保护它们免于被酸降解的肠溶包衣应该是一样的。
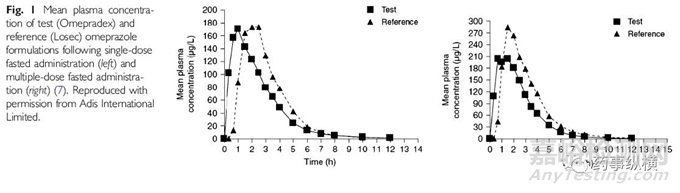
图1.(PPIs)单剂量实验中仿制药和参比制剂生物等效(左)。多次服用之后仿制药和参比制剂生物不等效(右)
案例二:具有多相释放行为的缓控释制剂
第二个例子介绍具有多相释放行为的缓控释制剂,其药时曲线对于临床治疗具有非常重要的价值。对于快速释放的仿制药,一般只要其AUC和Cmax与参比制剂一致,我们就认为两者生物等效。但是对于具有多相释放行为的缓控释制剂,适用于评价单相释放行为的传统的方法不能反映出缓控释制剂的关键制剂属性。
比如说不同规格的哌甲酯制剂能够在起始的时候快速释放发挥药效,之后缓慢释放维持药效,从而可以应对不同的临床需求。20mg规格的哌甲酯胶囊在起始的能够释放30%的药物,之后再缓慢释放剩余的70%的药物,而18mg规格的哌甲酯片剂在起始的时候释放22%的药物,剩余的78%药物储存在渗透泵中可以维持零阶释放,不受pH和水动力的影响。

图 2:20mg胶囊剂和18mg片剂的血药浓度
因此这两种设计不同的药物,在被人体吸收后具有不同的药时曲线,对比研究表明这两种药物具有不同的临床价值,因此在治疗效果上也不能等效,然而用传统的生物等效实验评价却表明则这两种制剂生物等效。
表1:哌甲酯20mg的胶囊剂和18mg片剂药代动力学参数比较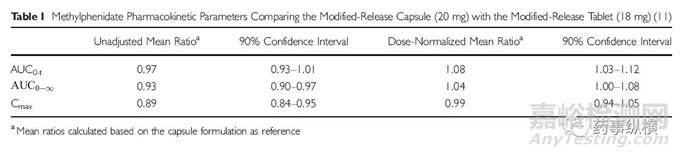
案例三:设计缓控释制剂时需要了考虑剂量倾泻
第三个例子介绍缓控释制剂设计时考虑剂量倾泻的重要性,一般情况下,缓控释制剂在设计之初应该特别重视剂量倾泻的风险。
二十几年前人们已经知道即使在快速释放快速吸收时没有问题的药品,在人体进食的时候也很有可能发生剂量倾泻。这也是缓控释制剂在设计时应该考虑进食的重要原因。然而随着现在药物设计的越来越复杂,人们意识到传统的生物等效试验不能说明仿制药没有剂量倾泻的风险,剂量倾泻的风险又回到人们的视线。
举个例子,作为没有考虑或降低剂量倾泻风险的产品,Palladone(氢吗啡酮
盐酸缓释胶囊)有用到一种在能够在酒精溶液中溶解的释放速率控制辅料,随着Palladone的广泛应用,人们发现一部分人如果服药的时候饮用含有酒精的饮料,就能大大吸收Palladone到致死剂量,有剂量倾泻的风险。
研究也表明服用含酒精饮料能够将血药浓度提高至6倍!即使只喝2/3杯的啤酒,也能将血药浓度提高至2倍。最终导致FDA要求停止销售该药物。
同样的对于透皮给药系统,尤其是含有低浓度就能发挥很强功效的药物,需要特别考虑剂量倾泻的风险。透皮给药系统分为储库型给药系统和基质型给药系统,而这两种给药系统发生剂量倾泻的风险是不一样的。储库型给药系统因为很容易泄露,因此其比基质型给药系统更容易发生剂量倾泻。
结语:现在仿制药一致性评价如火如荼,我国仿制药产品的质量经过“仿制药一致性评价”势必也将取得巨大的提升,人民的用药安全有效也将得到保证。然而仿制药一致性评价不仅应该关注 “溶出”和“预BE”,我们也要注意到剂型设计机理仿制药一致性评价中的重要作用。应该对RLD进行充分研究和了解,并了解其体内释放行为(iDDP)将其作为QTPP的一部分,如本文中提到的QTPP表格。


来源:Internet


