您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-04-29 09:06
1、一张图
要把框架说清楚,必须要从法规狗进入行业时最先接触到的一张图说起。相信很多人已经见过这张图了。
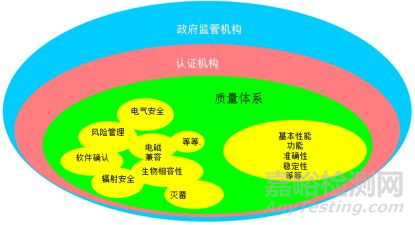
看到这张图你把自己想象成药监局的审评老师,想想审评老师在发证之前要看到哪些东西? 要确认哪些问题呢?
1. Yellow part
首先请看上图黄色的部分,黄色的部分是和医疗器械产品相关的,左边是产品的安全性,右边是产品的有效性。你可以马上联想到这个是医疗器械监管的两大基本原则,作为医疗器械的厂商就是要证明产品的安全性和有效性。图中的安全性提到了很多项目,包括电气安全,电磁兼容,生物相容性,灭菌,辐射安全,软件确认,风险管理等等。
图中的有效性举了基本性能,功能,准确性和稳定性的例子。不同的产品涉及到的安全性和有效性的项目会有所不同。
问大家一个问题,医疗器械厂商是通过什么方法证明器械的安全性和有效性的呢? 答案很简单,大部分情况下医疗器械厂商是通过型式试验的方式去证明的。型式试验是选取一定数量的样品去做的,通过测试只能证明样品是安全有效的。那工厂每天生产出来的产品该怎么办呢?如果你愿意你可以天天去做型式试验,但问题是你不一定愿意。那怎么办呢?
2. Green part
请看图中绿色的部分。绿色的部分就是质量管理体系的要求,质量管理体系的目的就是要把围绕医疗器械生命周期开展的活动规范化,文件化,严格按照文件的要求去做,并且留下相应的记录。如果你真的是这么去做了,可以达到一个效果,那就是保证工厂持续不断生产出来的产品是和当初做型式试验的样品一样安全一样有效的。质量管理体系就像是一把伞,在这把伞的保护下,产品不会有“日晒雨淋”的情况发生。
3. Pink part
再往上看粉红色的部分,粉红色的部分指的是认证机构,认证机构在医疗器械的监管中也发挥着重要的作用,当然这一条并不适用于所有的国家。我们分别以欧盟和中国为例来说明这个问题。欧盟如果做过CE认证的厂商都知道,CE认证的发证权利是在公告机构(Notified body)手上,欧盟委员话把医疗器械CE认证的发证权利授予了公告机构。但是中国就没有类似的公告机构,如果你要做医疗器械的注册,你只能和药监局(国家总局或地方局)打交道。
4. Blue part
最外圈蓝色的是政府监管机构,这个非常好理解,一般来说每个国家都有一个相应的政府机构负责医疗器械的监管。比如美国的FDA, 欧盟各成员国的主管机构,中国的NMPA。
2、图的作用
说起这张图的作用,我觉得用润物细无声来形容最合适了,看上去是一张平平淡淡的图片,但是作用不小。具体来说有两个作用:
这张图可以帮助大家厘清法规监管的框架,这样你在学习法规的时候就不会有负重前行的感觉了,负重前行的原因是思路没有厘清,这张图可以帮你厘清思路。
可以增强有效沟通。从事法规工作的人都有碰到过这样的情况,明明是和产品相关的要求,讨论着讨论着扯出了体系的要求,产品和体系的要求就混在一起了,就有可能偏离之前的主题,导致沟通不是特别有效。当碰到这种情况的时候,大家都回到这张图,仔细想想这到底是产品的要求还是体系的要求,达成一致以后再往下讨论,这样沟通会更加有效。

来源:启升资讯


