您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-28 09:15
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
豪森氟马替尼获批中国上市。豪森的1类新药甲磺酸氟马替尼(昕福)获国家药监局批准上市,用于治疗费城染色体阳性的慢性髓性白血病(Ph+ CML)慢性期成人患者。甲磺酸氟马替尼是一种酪氨酸激酶抑制剂,是针对Bcr-Abl(一种基因类型)的第二代TK 抑制剂药物,可以认为是升级版的格列卫。一项III期临床结果显示,对于我国初诊慢性髓系白血病慢性期(CML-CP)患者,氟马替尼与伊马替尼的安全性相当,但氟马替尼在3个月、6个月和12个月时的疗效均优于伊马替尼。
国内药讯
1.DPP-4抑制剂「阿格列汀」首仿获批。亚宝药业4类仿制药苯甲酸阿格列汀片获国家药监局批准上市,成为阿格列汀国内首仿药。阿格列汀(Alogliptin)是一种二肽基肽酶4(DPP-4)抑制剂,该药原研药由武田研发,商品名尼欣那,2010年4月在日本批准用于治疗2型糖尿病。目前,国内已经有5个DPP-4酶抑制剂上市,分别是西格列汀、沙格列汀、维格列汀、阿格列汀和利格列汀。公开数据显示,2017年苯甲酸阿格列汀片全球销售额达537亿日元 (约35亿人民币)。
2.默沙东Keytruda组合疗法在华获批一线治疗NSCLC。默沙东(MSD)公司重磅PD-1抑制剂Keytruda与卡铂或紫杉醇联用的组合疗法,获国家药监局批准一线治疗转移性鳞状非小细胞肺癌(NSCLC)患者。目前,Keytruda与化疗的组合已获批一线治疗鳞状和非鳞状NSCLC患者,Keytruda单药疗法获批一线治疗表达PD-L1的NSCLC患者(TPS>1%)。一项Ⅲ期KEYNOTE-407研究中国亚组中期分析数据显示,与单纯化疗相比,Keytruda联合化疗降低56%的死亡风险(而全球研究这一数据为29%,中国人群数据优于全球数据),两组中位OS分别为17.3个月vs12.6个月;降低68%的疾病进展或死亡风险,两组中位PFS分别为8.3个月vs 4.2个月。
3.安斯泰来恩扎卢胺获批进口。安斯泰来恩扎鲁胺胶囊获国家药监局批准,用于雄激素剥夺治疗失败后无症状或有轻微症状且未接受化疗的转移性去势抵抗性前列腺癌(mCRPC)成年患者的治疗。恩扎卢胺(Enzalutamide)最早是安斯泰来和Medivation共同开发的新一代雄激素受体抑制剂,2016年8月辉瑞收购Medivation公司将该品种收入囊中。该药最早于2012年8月获FDA批准,用于治疗晚期去势抵抗前列腺癌(CRPC),商品名为 Xtandi,2018年Xtandi全球销售额达到36.24亿美元。目前国内已有7家企业布局恩扎卢胺仿制药。
4.绿叶制药利培酮微球LY03004申报上市。绿叶制药自主研发的创新制剂——注射用利培酮缓释微球(LY03004)的新药申请获国家药监局受理。LY03004拟用于治疗精神分裂症,以肌肉注射的方式每两周给药一次。此前,该药物已在美国进入NDA阶段,其生产基地已通过美国FDA的上市批准前检查(PAI)。中美临床结果显示LY03004具有良好的安全性,在达到稳态后,与另一种市售药物达到生物等效。此外,LY03004可改善口服抗精神病药物在精神分裂症患者中普遍存在的用药依从性,并将简化精神分裂症的疗程。
5.辉瑞公布ARCHER 1050研究中亚洲亚组的积极结果。在ESMO Asia2019大会上,辉瑞(PFZ)旗下第二代EGFR TKI达可替尼(dacomitini)的ARCHER 1050研究亚洲患者亚组分析结果公布:与吉非替尼相比,达可替尼一线治疗EGFR敏感突变晚期非小细胞肺癌(NSCLC)患者可显著延长其无进展生存期(PFS)(中位PFS:16.5个月vs 9.3个月);显著延长总生存期(OS)(中位OS:37.7个月vs 29.1个月),提高了8.6个月;达可替尼组的中位缓解持续时间为16.6个月,是吉非替尼组的2倍。
6.CDE发布药品注册审评结论争议解决程序新规。国家药监局药品审评中心(CDE)官网发布"关于公开征求《药品注册审评结论争议解决程序》意见的通知"。FDA是国际上较早在药品审评结论中施行争议解决机制,科学高效开展药品注册审评,美国药品审评结论争议解决程序经过十余年发展,其法规体系逐步完善和细化。我国药品注册审评结论争议解决机制目前尚不完善,主要以复审为主体的争议解决机制还存在诸多问题,因此,国家药监局药品审评中心借鉴FDA经验,计划建立一套符合国情的药品审评争议解决机制。
国际药讯
1.全球首个英夫利昔单抗皮下注射制剂在欧盟获批。Celltrion公司英夫利昔单抗生物类似药的皮下注射制剂Remsima SC(CT-P13 SC)获欧盟委员会(EC)批准,用于类风湿性关节炎(RA)患者的治疗。Remsima SC是全球首个皮下注射制剂的英夫利昔单抗产品,可由患者自行注射。一项临床研究结果显示,在治疗第30周将RA患者由CT-P13静脉(IV)制剂改为CT-P13皮下(SC)制剂治疗,与一直维持CT-P13 SC治疗组相比,在第54周的疗效具有可比性(安全性观察至第64周)。Celltrion公司还向欧洲药品管理局(EMA)就Remsima SC的营销授权提交进一步的变更,以将其扩展至炎症性肠病,预计将在2020年年中做出批准决定。
2.口服糖尿病创新疗法再获Ⅲ期积极临床数据。Poxel SA公司开发的口服glimin类创新药物imeglimin,在治疗对胰岛素单药治疗反应不良的2型糖尿病患者的Ⅲ期临床TIMES 3开放标签扩展研究部分获积极顶线结果。在开放标签扩展研究中,所有患者都接受imeglimin与胰岛素联合治疗36周后,原先在imeglimin组或安慰剂组的患者的糖化血红蛋白(HbA1c)水平与基线相比,分别降低0.64%和0.54%。今年4月,imeglimin已在Ⅲ期临床TIMES 1中达到主要临床终点,将患者HbA1c水平与基线相比降低0.87%。Poxel公司计划于2020年在日本递交其上市申请。
3.Intercept奥贝胆酸获FDA优先审评资格。Intercept Pharmaceuticals公司特异性法尼醇X受体(FXR)激动剂奥贝胆酸(OCA)的上市申请(NDA)获FDA受理,并获授予优先审评资格。该药拟用于治疗由于非酒精性脂肪性肝炎(NASH)导致的肝纤维化。FDA预计在明年3月26日之前作出回复。如果获批,这将是首款获批治疗NASH导致的肝纤维化的创新疗法。一项Ⅲ期临床REGENERATE结果显示,在接受18个月的不同剂量OCA治疗的NASH患者群中,肝纤维化改善超过1级且NASH症状没有恶化的患者比例为17.6%(10 mg)和23.1%(25 mg),安慰剂组这一数值为11.9%。目前这项试验仍在进行中。
4.致幻蘑菇成分药物psilocybin治疗抑郁症获突破性疗法认定。Usona研究所宣布,FDA授予psilocybin用于治疗抑郁症(MDD)患者的突破性疗法认定。psilocybin此前已获治疗“治疗抵抗性抑郁症”(TRD)患者的突破性疗法认定。Psilocybin又名裸盖菇素,它是致幻蘑菇中产生的一种天然神经毒素,有着强烈的致幻和让人感到欣快的作用。目前,Usona研究所在美国启动了评估单一剂量psilocybin治疗21岁至65岁MDD患者的Ⅱ期临床PSIL201研究,预计入组80例MDD患者。
5. 再心生物与阿斯利康达成一项研发合作。再心生物(Novoheart)公司与阿斯利康达成一项研发合作,将利用再心生物的hvCOC技术,共同开发全球首款体外射血分数保留型心力衰竭(HFpEF)的人源化模型,为未来评估新型疗法提供独特的解决方案。据悉,再心公司专有的3D人类心室心肌空腔(hvCOC)技术(也称微型人类心脏)可以再现HFpEF的关键表型特征,是目前市场上唯一能够对人类心脏泵性能(包括射血分数和形成压力)进行临床评估的人体工程心脏组织。再心公司将拥有HFpEF hvCOC新模型的独家知识产权。
6.Azeria公司完成B轮融资。Azeria公司完成B轮3200万英镑(4100万美元)的融资。Azeria成立于2017年,致力于为激素耐受性乳腺癌患者开发突破性疗法。该公司目前正在开发一项针对FOXA1驱动的雌激素受体阳性乳腺癌项目,FOXA1是一种先驱转录因子,已被证明在雌激素受体阳性管腔型乳腺癌肿瘤的生长、进展和维持中起关键作用。大量的靶点验证和药物发现工作已为FOXA1项目提供了支持。本轮资金将用于FOXA1小分子抑制剂的研究,推动其尽快步入临床开发。
医药热点
1.我国器官捐献与移植量亚洲第一。国家卫健委在例行新闻发布会上,介绍我国人体捐献器官转运绿色通道相关情况。国家卫健委医政医管局监察专员介绍,目前,我国年器官捐献与移植数量已位居亚洲第一位、世界第二位,国际能开展的大器官移植手术在我国均能开展,肝脏、心脏、肺脏移植多个单中心移植数量位居世界前列。据介绍,2010年~2019年10月,我国累计完成公民逝世后器官捐献2.6万余例,捐献大器官突破7.4万个。2019年上半年,我国完成公民逝世后器官捐献2757例,同期增长9.5%;捐献器官数量达7186个,同期增长3.6%。
2.4个介入类临床规范修订。国家卫健委发布2019年版的心血管疾病介入、综合介入、外周血管介入、神经血管介入4个介入类诊疗技术临床应用管理规范。新版规范对开展相关技术临床应用的医疗机构条件、医务人员条件、技术管理要求做了适当调整:取消了医疗机构的准入审批和医疗机构等级限制;取消了医务人员的审批备案;加强了对相关技术临床应用的事中事后监管措施,明确要求医疗机构将相关技术纳入手术分级管理,并对手术分级管理目录进行了指导推荐。
3.贵州出台病床位价格管理办法。贵州省医保局印发《贵州省公立医疗机构病房床位价格管理办法》。《办法》规定,公立医疗机构普通类、特殊类病房床位价格由省医保部门统一制定;特需病房床位由公立医疗机构自主制定。特需类病房床位数不得超过本机构编制床位数的10%。《办法》明确,需要严格隔离、消毒损耗大的专设感染性疾病科、精神科、烧伤科、肿瘤科、血液科病房床位按同等病房收费价格加收50%;专设烧伤翻身床按烧伤病床价格再增加一倍收费;按医嘱需使用骨科牵引病床的,在同等同级病房床位价格基础上加收15%。
【以岭药业】盐酸二甲双胍片通过一致性评价。
【泰格医药】高管WEN CHEN减持计划实施期限已届满,其未在减持区间减持公司股份。
【天坛生物】公司下属国药集团上海血液制品有限公司委托招标代理机构对云南项目勘察-设计-施工总承包项目(EPC)进行了公开招标,本项目经法定公开招标程序,中标候选人国药工程中标,合同总金额为中标价格6.30亿元。
审评动向
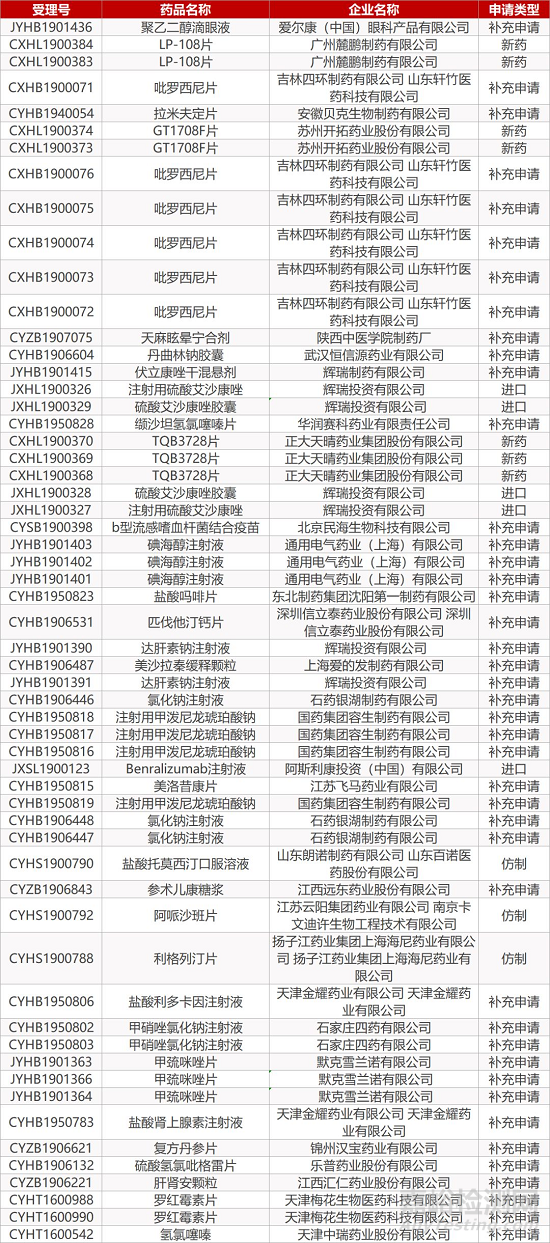
1. CDE最新受理情况(11月27日)
2. FDA最新获批情况(北美11月26日)
暂无

来源:药研发


