您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-02-26 08:34
2025年2月20日,FDA发布了一篇在2024年11月20日的483,是给到国内某制药企业,共有8个发现项:主要是数据完整性和记录管理、质量控制和调查、生产设备和工艺管理、清洁验证和样品采集等。
下面主要针对发现项3进行回顾,并给到调查指南和案例讨论。
OBSERVATION 3:实验室调查不充分
对于设备清洁样品的超标(OOS)调查,未提供科学依据和文件记录来支持根本原因的判断。
具体案例:
(1)使用新的TOC样品瓶被认为是导致测试失败的原因,但未进行模拟实验验证。(2)未记录清洁样品溶液制备的原始数据,导致调查结果不可靠。
OBSERVATION 3
观察项 3
Laboratory investigations are not adequately conducted to determine the root cause.
未充分开展实验室调查以确定根本原因。
Specifically,
具体来说
Your Out-of-Specification (OOS) investigations for equipment cleaning samples (rinse and swab) failures do not include scientific justification supported with documented evidence for the probable root cause based on which the investigations were closed. For example,
你们针对设备清洁样本(冲洗样和擦拭样)不合格情况所开展的超标(OOS)调查中,并未包含基于合理推测出的可能根本原因且有文件记录证据支持的科学依据,而调查却据此结案。例如
A.OOS investigation numbers: OOS-CQC 22149, OOS-CQC 150, and OOS-CQC 151, date initiated: December 13, 2022, description of OOS event:(b)(4) Cleaning solution batch was not within acceptance limit criteria for TOC test. The following results were obtained:
超标(OOS)调查编号:OOS-CQC 22149、OOS-CQC 150和OOS - CQC 151,发起日期:2022年12月13日,超标事件描述:(b)(4)清洁溶液批次的总有机碳(TOC)测试结果不符合接受限度标准。结果如下
lFor OOS-CQC 22149, Batch number:(b)(4)
, Result:(b)(4)mg/L, Acceptance Limit:< (b)(4)mg/L, Sample type: Rinse sample, Equipment type:(b)(4)ID: (b)(4)
对于 OOS-CQC 22149,批号:(b)(4) ,结果:(b)(4) mg/L,接受限值:<(b)(4) mg/L,样品类型:冲洗样品,设备类型:(b)(4) ID:(b)(4)。
lFor OOS-CQC 22150, Batch number:(b)(4), Result:(b)(4)µg/cm2, Acceptance Limit: <(b)(4) µg/L, Sample type: Swab sample, Equipment type(b)(4)ID: (b)(4).
对于 OOS-CQC 22150,批号:(b)(4),结果:(b)(4) µg/cm,接受限:<(b)(4) µg/L,样品类型: 拭子样品,设备类型(b)(4) ID:(b)(4)。
lFor OOS-CQC 22151, Batch number:(b)(4), Result:(b)(4)µg/cm2, Acceptance Limit: <(b)(4) µg/L, Sample type: Swab sample, Equipment type(b)(4)ID: (b)(4)
对于 OOS-CQC 22151,批号:(b)(4),结果:(b)(4) µg/cm2,接受限:<(b)(4) µg/L,样品类型:拭子样品,设备类型:(b)(4) µg/L:拭子样品,设备类型(b)(4) ID: (b)(4)。
Your Quality Unit determined the probable root cause for failing test result was due to the use of a new TOC sample bottle. We observed the following deficiencies in these OOS investigations:
你们的质量部门认定测试结果不合格的可能根本原因是使用了新的总有机碳(TOC)样品瓶。我们在这些超标(OOS)调查中发现了以下缺陷:
1)There were (b)(4)cleaning samples (swab and rinse) analyzed using TOC. During your Phase I (laboratory investigation), your firm failed to determine that the raw test data pertaining to cleaning sample solution preparation, along with calculations used for calculating test results, were not documented for all samples tested using TOC. In the absence of documented raw test data, there is no assurance over the reliability of reported test results for all samples.
共有(b)(4)个清洁样本(擦拭样和冲洗样)采用总有机碳(TOC)分析法进行了检测。在你们的第一阶段(实验室调查)期间,你们公司未能确认与清洁样本溶液制备相关的原始测试数据以及用于计算测试结果的计算过程,并未针对所有采用TOC检测的样本进行记录。由于缺乏有记录的原始测试数据,无法确保所有样本所报告的测试结果的可靠性。
2)There was no simulation experiment conducted to scientifically prove whether the above three cleaning samples failed to meet acceptance limit was due to the use of a new TOC sample bottle.
并未开展模拟实验,以从科学角度证明上述三个清洁样本未能达到接受限度是否是由于使用了新的总有机碳(TOC)样品瓶所致。
As a result of the deficiencies mentioned above and categorizing the root cause due to laboratory error, your firm did not reclean equipment(b)(4) and(b)(4) continued to use them in the manufacturing of APIs.
由于存在上述缺陷,且将根本原因归结为实验室误差,贵公司并未对设备(b)(4)进行重新清洁,而是继续使用这些设备来生产原料药。
B.OOS investigation number: OOS-COC 24011, date initiated: January 30, 2024, description of OOS event:(b)(4) Cleaning solutionbatch (b)(4) was not within acceptance limit criteria for TOC test.
B.超标(OOS)调查编号:OOS-COC 24011,发起日期:2024年1月30日,超标事件描述:(b)(4)清洁溶液批次(b)(4)的总有机碳(TOC)测试结果不符合接受限度标准。
Result:(b)(4)mg/L, Acceptance Limit: ≤ (b)(4)mg/L, Sample type: Rinse sample.
结果:(b)(4)mg/L,接受限值:≤(b)(4)mg/L,样品类型:冲洗样品。
Your Quality Unit determined the probable root cause was due to the production operator keeping the stopper of the sampling flask on the ground before sampling, thereby contaminating the cleaning solution from the stopper. We observed the following deficiencies:
你们的质量部门认定可能的根本原因是生产操作人员在取样前将取样瓶的瓶塞放在地上,从而使瓶塞上的污染物混入了清洁溶液中。我们发现了以下缺陷:
1)During your Phase I (laboratory) investigation, your firm failed to determine that the raw test data pertaining to cleaning sample solution preparation, along with calculations used for calculating test results, were not documented for all samples tested using TOC. In the absence of documented raw test data, there is no assurance over the reliability of reported test results for all samples.
在你们的第一阶段(实验室)调查期间,贵公司未能确认与清洁样本溶液制备相关的原始测试数据以及用于计算测试结果的计算过程,并未针对所有采用总有机碳(TOC)检测的样本进行记录。由于缺乏有记录的原始测试数据,无法确保所有样本所报告的测试结果的可靠性。
2)There is no documentation of the total number of samples collected by the operator and the impact of his sample collection technique on other cleaning samples test result reliability.
没有关于操作人员所采集样本总数的记录,也没有记录其采样技术对其他清洁样本测试结果可靠性的影响。
As a result of the deficiencies mentioned above and categorizing the root cause to the production operator's sample collection technique, your firm did not re-clean the equipment and continued to use them in the manufacturing.
由于上述缺陷,并将根本原因归结为生产操作人员的采样技术问题,贵公司并未对设备进行重新清洁,而是继续在生产过程中使用这些设备。
下面是江苏省局关于药品生产检验结果超标调查指南制定的地方标准,对于出现OOS调查不充分的情况解决会有一些启发与帮助。
1. 范围
药品生产检验结果超标调查指南
本文件提供了药品生产检验结果超出标准时对超标数据的调查流程和方法。
本文件适用于超出质量标准的实验室检验项目,包括物料(原料药、辅料、药品包装材料)、中间产品、成品及稳定性考察样品等的检验。
本文件不适用于分析方法验证、检验员培训,新购进仪器和系统验证(如计算机化系统)期间产生的数据,过程分析技术(PAT)产生的数据,微生物相关检验项目。
2. 基本流程
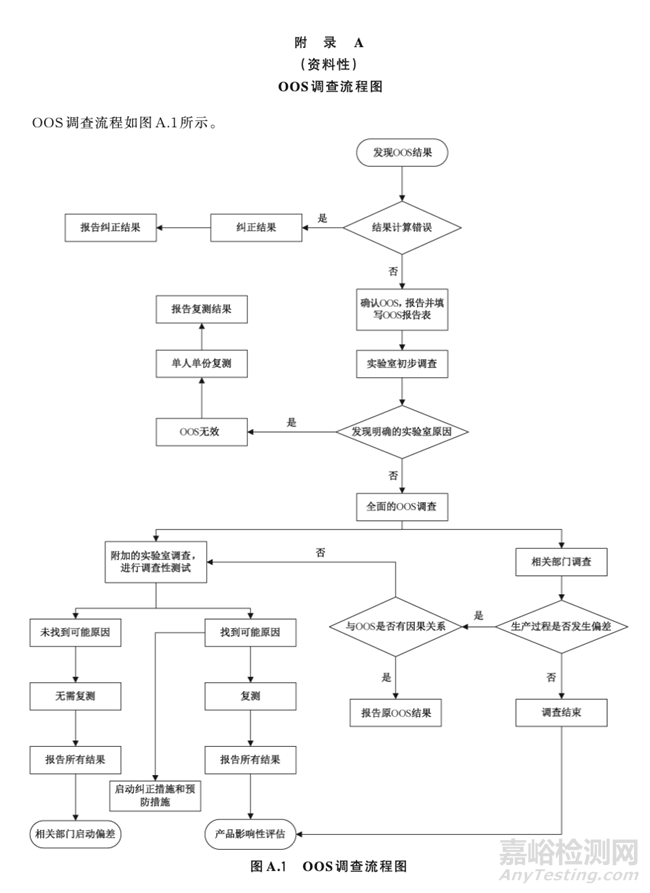
OOS调查流程分为两个阶段,第一阶段为实验室初步调查;第二阶段为全面的OOS调查,包括相关部门调查和附加的实验室调查。调查流程见附录A。
3. OOS报告
3.1 检验员判断OOS结果
检验员使用的仪器设备性能应符合检验要求,并经校准/检定。
当确认的系统适用性不符合要求时,不应用于样品检验,应对原因进行排查,若已有数据产生,应对 数据进行评估,并采取纠正措施和预防措施。
实验过程中发生明显错误,如样品溶液泄漏或样品溶解、转移不完全,检验员应立即对所发生情况加以记录,同时报告实验室负责人。检验员不应继续实验,以期望结果符合规定,或结果不符合规定时通过明显实验异常来判定数据无效。
检验员按照批准的SOP或方案对样品进行检验,在样品检验完成后,销毁供试样前,应检查数据是否符合质量标准。如果不符合质量标准,经检查检验记录和计算过程准确无误后,即判断该结果为OOS,并立即向实验室负责人报告,同时对实验现场进行保护。在报告时,注意正确使用平均值。
示例:
某制剂品种含量标准为95.0%~105.0%,平行样1检验结果为94.7%,平行样2检验结果为95.3%,平均值为95.0%,平均值符合规定,平行样1不符合规定,报告OOS。
3.2 实验室负责人审核
实验室负责人组织人员对OOS数据的准确性进行确认,若检验记录和计算过程准确无误,则确认为OOS结果,同时回顾其重复发生情况,并一同报告给质量保证部门。
3.3 质量保证部门风险评估质量保证部门收到OOS报告后,根据OOS来源进行初步的影响评估和预防行动。
a) 当OOS来自中间产品时,应评估是否需要暂停生产。中间产品一般具有时效性,经评估可优先进行重新取样和复测。因时间紧急非书面报告复测结果的,应有相关审批流程,并尽快提交书面报告。
b) 当OOS涉及已上市产品时(如稳定性考察样品),质量保证部门应优先关注,以确认是否需要告知药品监管部门。应根据OOS事件的风险程度,确定完成实验室调查的时间表。如调查结果可能会影响上市产品的质量趋势,应制定相关产品的后续稳定性考察跟踪计划。
4. 实验室初步调查
4.1实验室调查
在实验室初步调查过程中,实验室负责人不应预先直接假定OOS发生的原因,应与检验员一起对 可能的原因进行客观及时的调查。主要是对检验过程中涉及的人、机、料、法、环等方面进行初步排查。 如发现明显异常,应如实记录现场情况,保留可供调查的证据,包括但不限于下列情况。
a)人员:人员是否经过培训,是否具备相应的知识、技能和经验,是否能够正确执行检验操作,是否 正确使用仪器、分析器具和试剂。
b) 仪器设备:
1) 仪器设备运行是否正常,如采用高效液相色谱仪时,进样过程中色谱柱柱压是否稳定;基线、噪声等是否满足要求;
2) 仪器是否进行校验,校验结果是否在合格范围内,校验用标准是否正确;
3) 可对供试溶液的原进样小瓶中溶液(确保溶液稳定)在原检验条件下再次检验,以排查是否为仪器错误。
c) 样品信息及供试溶液制备:
1) 样品的分发、处理是否正确;
2) 包装、贮存条件是否符合相关SOP规定;
3) 对照品、比色液等是否正确,是否在有效期内;
4) 供试溶液制备过程是否与SOP规定的相一致,制备过程中有无发生明显的操作错误或出现异常现象,如移液、稀释、定容过程、过滤时间及过滤方式、针头式过滤器材质等是否正确。溶液配制过程中是否存在提取时间不足的情况。
示例2:
试验过程中所用的容量瓶或移液管的规格是否与SOP规定的一致。
d) 检验方法: 方法是否经过验证或确认,方法参数设置等是否正确。
e) 环境:确认溶液配制过程、样品储存过程中的环境温湿度是否正常;是否符合样品的特殊要求,如避光等。
f) 其他排查:可根据产品特性,对可能影响检验结果的关键参数进行额外排查,如可对历史检验数据进行排查,同时查看其他批次的稳定性考察样品是否存在相同情况。
4.2质量保证部门评估
质量保证部门对实验室初步调查结果进行评估,评估项目包括但不限于调查结果的充分性、是否需 要进一步启动全面调查等。若初步调查阶段发现存在明显的实验室错误,且确定该错误是导致出现OOS结果的直接原因,可不进行全面调查。实验室针对发现的原因,启动纠正措施和预防措施,同时安 排原检验员或更换其他检验员按照批准的复测方案进行单人单份复测,复测样品来源可根据7.4.2执行。
5. 全面的OOS调查
5.1 全面调查的启动
当初步调查未发现明显的实验室错误,或发现可能的实验室错误,仍需进一步证实该错误与OOS结果的关联性,则进入全面的OOS调查。
全面的OOS调查,应成立调查小组,指定有资质的质量保证人员为负责人,包括相关部门调查和附 加的实验室调查两部分。涉及的相关部门,应根据异常现象对本部门内部进行调查并提交调查报告。最 终由质量保证人员审核评价调查是否充分。
5.2 相关部门调查
此调查应涉及所有与OOS可能有关的其他部门,包括取样、生产、仓储、工程、设备等。由各部门指定人员进行调查,如物料入库包装是否正常,取样器具是否经过清洗,生产过程中各部中间产品存储环境 是否符合要求等。所有涉及的工厂场地都应当被包括在调查之中,若由合同生产商或多个生产厂地生 产,则需同时对潜在的问题进行确认和调查。
经调查发现,在生产过程中发生过偏差,如该偏差会导致此次OOS结果,可不进行附加的实验室调 查,直接报告原OOS结果,扩展到其他批次或者其他产品的不合格调查应继续完成;如该偏差不会导致 此次OOS结果,附加的实验室调查仍应继续进行。
5.3 附加的实验室调查
实验室负责人与检验员一起对检验过程再次地深入调查,确定可能会导致OOS结果的实验室原因,以制定调查性检验方案,经质量保证部门批准后可执行。调查性检验方案示例见附录B。
5.4复测
5.4.1复测方案的制定
实验室负责人需根据调查的最终结论确认OOS的复测方案,并由质量保证部门批准后执行。复测 次数应按照批准的复测方案执行,不应根据复测结果对复测次数进行调整,直至得到预期的结果。
a) 未找到可能的原因,无需复测,报告所有结果,生产部门或相关部门应针对导致OOS的所有原因启动偏差调查程序。
b) 找到可能原因,分为以下两种情况。
1) 可能的原因得到证实,实验室至少进行单人单次复测,即由一名检验员(原检验员或更换其他检验员 )按照SOP要求对发生OOS的项目进行一次完整检验,重新检验的结果取代最 初检验结果,若复测结果不符合规定,且与原OOS现象一致,则实验室不再进行调查,直接报告原结果。
2) 可能的原因未得到证实,可根据统计学原理,安排其他检验员进行多人多次复测,如3名检 验员分别进行2次完整异常项目的检验或1名检验员进行5次、7次或9次完整的异常项目 的检验,复测检验员与原检验员应有同等的经验和资质。
如果复测有任一次结果不符合质 量标准规定,则报告原OOS结果和全部复测结果,以原OOS结果为最终报告结果。如果 所有的复测结果都符合质量标准规定,则报告原OOS结果和全部复测结果。质量保证部 门在批放行时应考虑所有数据。
5.4.2复测样品的来源
复测优先使用实验室同批剩余的样品或留样,以保证样品的一致性。重新取样将根据批准的取样方 案进行,以下情况可申请重新取样:
a) 经过前面的调查评估,样品不具有批次质量代表性;
b) 由于产品的特性(如吸湿性、光敏等),重新检验原来的样品已不具有代表性; c)实验室剩余样品不足检验量。
6. OOS调查结论
调查结果应找到导致OOS发生的根本原因。如果最终确认检验结果超标是因为样品不符合质量标准,应由相关部门启动偏差调查并进行整改。
7. 纠正措施与预防措施
针对产生OOS的根本原因采取相应的纠正措施和预防措施,质量保证部门需对纠正措施及预防措 施的实施情况进行审核确认。
示例:
检验员在试验过程中将20 mL容量瓶错拿成25 mL容量瓶,导致检验结果不符合规定。表面现象是人员粗心,拿错 容量瓶,根本原因是两种规格的容量瓶外观接近,易混淆,在整改过程中,除了加强人员培训外,需针对根本原因(容量瓶 外观接近易混淆)制定纠正措施,如将外观接近的容量瓶放置在不同的位置,使用不同颜色的盖子或绳子进行区分。作为预防措施,实验室需对其他外观接近易混淆的容器进行相应整改,如相近规格的移液管分区存放等。
10. OOS总结分析
定期对所有的OOS进行趋势分析,确认已采取的纠正措施和预防措施是否有效,同时针对重复发 生的同类型OOS,确认是否需要进一步采取纠正措施和预防措施。
附录B
(资料性)附加的实验室调查示例
下面给出全面的OOS调查阶段附加的实验室调查示例。
示例1:
某注射剂有关物质项目检验,未知单杂平行样1为0.24%,平行样2为0.10%,标准规定未知杂质不能超过0.20%。检验结果不符合规定,启动OOS。备注:该实验中供试溶液配制过程:取该产品4支,倒至同一烧杯中,混合均匀,分别倒入 两个进样小瓶。
初步调查阶段,将两个原进样小瓶中溶液重新进样,杂质峰位置及大小均重现,基本排除仪器偶发因素,未发现根本 原因,进入全面调查阶段。
在全面调查阶段,查阅该品种的方法验证资料,确认该杂质并非降解杂质;查阅历史检验情况,之前未检出该杂质峰。 可能在其他阶段引入污染,根据以上调查情况制定调查性检验方案:
调查性检验方案1: 推测进样小瓶被污染,导致检验结果异常。将原供试溶液分别倒入3个新的进样小瓶,若均未检出 异常峰,则说明调查性检验方案成立,若仍检出杂质峰,则说明调查性检验方案不成立。
调查性检验方案2: 推测样品配制过程中烧杯瓶口污染,导致检验结果异常。分别采用吸取和倾倒两种方式将烧杯中 供试溶液转移至进样小瓶中,同时采用棉签对烧杯瓶口进行擦拭取样。若采用倾倒方式转移的溶液检出该杂质峰,采用 吸取方式转移的溶液中未检出该杂质峰,或明显小于采用倾倒方式转移的溶液,且瓶口擦拭提取液中也检验出该杂质峰, 则说明调查性检验方案2成立。对杂质进行质谱检验,分析污染物及污染方式。反之,调查性检验方案不成立。
示例2:
某制剂产品含量检验结果为89.0%,标准要求为90%~110%,检验结果不符合规定,启动OOS,实验室初步调查未发 现明显错误,全面调查阶段,为证实是否为原样品母液未摇匀导致的含量偏低,实验室制定调查性检验方案,对剩余原样 品母液进行充分振摇后,平行配制两份供试溶液,检验结果为90%、91%。平均值为90.5%,虽然符合质量标准,但检验结 果更倾向于肯定初始的OOS结果,不符合预期,调查性检验方案不成立。调查性检验的结果只能用于证明调查性检验方 案是否成立,不能用调查性检验结果代替原OOS结果。

来源:文亮频道


