您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-18 09:10
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
百济神州公布泽布替尼Ⅲ期临床ASPEN试验结果。百济神州公司公布其BTK抑制剂BRUKINSA™(泽布替尼)对比伊布替尼(J&J and AbbVie)用于治疗华氏巨球蛋白血症(WM)的Ⅲ期临床ASPEN队列1的试验结果。截至2019年8月31日,中位随访时间为19.4个月时,在R/R患者中,经IRC评估非常好的部分缓解率(VGPR)在泽布替尼组中为28.9%,在伊布替尼组为19.8%,两组均无患者达完全缓解(CR),组间差异不具统计显著性;在所有患者中,经IRC评估的VGPR率在泽布替尼组为28.4%,在伊布替尼组为19.2%,两组均无患者达CR,组间差异未达统计显著性;与伊布替尼相比,泽布替尼在安全性和耐受性上有明显改善。
国内药讯
1.神州细胞利珀妥单抗注射液申报上市。神州细胞利珀妥单抗注射液上市申请获国家药监局受理,其适应症为CD20阳性的弥漫性大B细胞淋巴瘤。这是国内第3款申报上市的利妥昔单抗生物类似药。利妥昔单抗是罗氏旗下基因泰克自主研发的一种人鼠嵌合抗CD20单克隆抗体,于1997年在美国率先获批上市,2018年全球销售额为69亿美元,同年的中国销售额为38.33亿元。目前,我国首个利妥昔单抗生物类似药(汉利康,复宏汉霖)今年2月已获批上市。信达生物今年6月也提交了该药的上市申请,预计2020年获批。
2.信立泰S086片临床申请获批。信立泰药业S086片获国家药监局临床试验默示许可。S086是信立泰自主创新研发的一种血管紧张素II受体-脑啡肽酶双重抑制剂,拟开发用于原发性高血压患者和慢性心力衰竭成人患者,降低心血管死亡和心力衰竭住院的风险。本次为新适应症“原发性高血压”获批开展临床试验。目前,S086片已完成Ⅰ期临床相关研究,原发性高血压适应症即将进入Ⅱ期临床阶段。
3.和誉医药FGFR4抑制剂临床申请获受理。和誉医药自主研发的具全球best-in-class潜力的FGFR4抑制剂ABSK011的临床申请获国家药监局受理。该药物刚刚在台湾地区获批临床,即将开展针对肝细胞癌的Ⅰ期临床研究。FGFR属于酪氨酸受体激酶家族,包括四种受体亚型(FGFR1-4),该家族的受体激活在多种肿瘤的生长、增殖、存活以及转移中起着至关重要的作用。研究发现,在肝癌细胞中经常存在FGFR4信号通路过度激活现象。截至目前,全球尚无针对FGFR4靶点的药物获批上市。
4.全球首个获批上市的双抗药物在中国提交临床申请。凌腾医药(Lintonpharm)双特异性抗体catumaxomab注射液(卡妥索单抗注射液)的临床申请获国家药监局受理。Catumaxomab是一种靶向CD3和EpCAM的双特异性抗体,该药曾于2009年获欧盟批准用于治疗恶性腹水,是全球首个获批上市的双特异性抗体,但是由于上市后表现欠佳,catumaxomab于2017年退市停产。该药物的发明人Horst Lindhofer博士是凌腾医药的联合创始人。根据凌腾医药官网,该公司预计将在2019~2020年重新在欧洲提交该抗体针对恶性腹水适应症的上市申请,并计划于2021年在中国上市catumaxomab治疗恶性腹水患者。
5.基石药业CDK4/6抑制剂国内申报临床。基石药业CDK4/6选择性抑制剂CS3002的临床申请获国家药监局受理。该在研药已在澳大利亚获批开展I期临床。在临床前研究的小鼠动物模型中,CS3002联合PD-1单抗或内分泌治疗均显示出了良好的抑制肿瘤生长的作用,且联合治疗优于单药治疗。目前,FDA已批准了3款CDK4/6抑制剂——辉瑞的Palbociclib、诺华的Ribociclib以及礼来的Abemaciclib。其中,Palbociclib已于2018年8月在中国获批用于治疗ER+、HER2-局部晚期或转移性乳腺癌,应与芳香化酶抑制剂联合使用作为绝经后女性患者的初始内分泌治疗,中文商品名为爱博新®。
国际药讯
1.Deciphera靶向疗法ripretinib申请上市。Deciphera公司已向FDA递交其KIT和PDGFRα激酶抑制剂ripretinib的新药申请,用于治疗已接受过imatinib,sunitinib和regorafenib治疗的晚期胃肠道间质瘤(GIST)患者。该药此前已获FDA授予快速通道资格和突破性疗法认定。一项Ⅲ期试验INVICTUS结果显示,与安慰剂组相比,ripretinib显著改善晚期GIST患者的无进展生存期(27.6周vs4.1周),将疾病进展或死亡风险降低85%;ripretinib组的客观缓解率为9.4%,而安慰剂组为0%;ripretinib组的总生存期为15.1个月,安慰剂组的仅为6.6个月,具有临床意义上的显著改善。再鼎医药达拥有ripretinib在大中华区的开发和推广独家授权。
2.Agios公司IDH1抑制剂获突破性疗法认定。Agios Pharmaceuticals公司IDH1抑制剂Tibsovo(ivosidenib)获FDA授予突破性疗法认定,治疗携带致敏IDH1基因突变的复发/难治性骨髓增生异常综合征。一项Ⅰ期临床结果显示,Tibsovo具有良好的耐受性,可使患者产生75%(9/12)的响应率和42%(5/12)的完全缓解(CR)率。在获得CR的患者中,60%的患者在12个月时仍未复发,中位CR持续时间尚未达到。此外,75%患者在研究治疗期间有56天或更长时间不依赖输血。Tibsovo此前已获FDA批准治疗携带致敏IDH1基因突变的复发/难治性急性髓系白血病(AML)患者。
3.Axsome抑郁症新药达Ⅲ期主要终点。Axsome口服创新NMDA受体拮抗剂AXS-05在治疗抑郁症(MDD)的Ⅲ期试验GEMINI中达主要终点。与安慰剂组相比,AXS-05显著改善患者的抑郁症症状;AXS-05组患者治疗6周后的MARDRS(蒙哥马利抑郁评定量表)评分较基线时下降16.6个点,而安慰剂组为11.9个点;此外,AXS-05组有39.5%的患者达疾病缓解(MADRS评分≤10),而安慰剂组为17.3%。此前,AXS-05已获FDA授予治疗MDD的突破性疗法认定,以及治疗抵抗性抑郁症和阿尔茨海默病的快速通道资格。Axsome计划在明年下半年递交其新药申请。
4.诺华DP2受体拮抗剂fevipiprant两项III期临床失败。诺华(Novartis)DP2受体拮抗剂fevipiprant(QAW039)关键性全球III期LUSTER-1和LUSTER-2研究失败。这些研究入组包括了接受吸入性中高剂量皮质类固醇和至少一种额外的控制药物但病情仍得不到控制的中重度哮喘患者。52周治疗的汇总分析结果显示,与安慰剂相比,2种剂量fevipiprant(150mg/450mg)没有达到降低中重度恶化率的临床相关阈值。研究中fevipiprant的耐受性一般良好,治疗引起的不良反应方面与安慰剂相当。
5.吉利德多种NASH组合疗法Ⅱ期临床失败。吉利德公布Ⅱ期临床ATLAS试验的研究结果。该试验招募392例严重纤维化(F3-F4)的非酒精性脂肪性肝炎(NASH)患者,比较ACC2抑制剂firsocostat、FXR受体激动剂cilofexor、二者双药组合、以及二者分别与ASK1抑制剂selonsertib组合与安慰剂对改善纤维化的影响。48周治疗结果显示,所有治疗组均没有显著增加无NASH恶化、至少改善一级纤维化患者的比例,错过该试验一级终点。但诸多二级终点有部分改善,详细数据将于未来的学术会议上公布。
6.Promethera公司完成D轮融资。致力于开发干细胞疗法的Promethera Biosciences公司完成共计4720万欧元(约5260万美元)的D轮融资,以推进其干细胞疗法HepaStem在治疗非酒精性脂肪性肝炎(NASH)和慢性加急性肝衰竭(ACLF)中的临床开发。Promethera专注于开发先天性和获得性肝病的治疗药物,它专有的技术能从不可移植的健康人肝脏中提取和纯化异体肝源性祖细胞,干细胞和成熟干细胞。这些细胞经处理成为注射产品后,能用于治疗多种肝脏疾病,包括如罕见疾病尿素循环障碍(UCD),ACLF,NASH,肝纤维化等。
医药热点
1.日本癌症患者5年存活率达66.4% 。据日媒报道,日本国立癌症研究中心发布一项该国癌症患者5年存活率的数据。数据显示,日本癌症患者整体5年存活率达66.4%,其中,存活率最高的是前列腺癌,达98.8%。排名2至5位的分别是乳腺癌(92.2%)、子宫内膜癌(82.2%)、喉癌(80.6%)以及肾癌(80.1%)。此外,5年存活率最低的依次为胰腺癌(9.8%)、胆囊癌(29.3%)、肝癌(40.4%)、肺癌(41.4%)以及食道癌(45.7%)。
2.十校联手打造长三角医学教育高地。长三角医学教育联盟成立,该联盟由复旦大学上海医学院、上海交通大学医学院、上海中医药大学、南京医科大学、苏州大学、南京中医药大学、浙江大学、温州医科大学、中国科学技术大学、安徽医科大学联合倡议发起,联盟将通过协同推进“四个一体化”发展:医学教育质量提升一体化、项目平台建设载体一体化、教育资源共建共享一体化、制度保障改革创新一体化,建设卓越的区域医学教育协作网络,培养适应长三角地区医疗质量均衡化发展的医学人才。
3.浙江实施“551卫生人才培养工程”。浙江省卫健委与财政厅联合制定《浙江省新一轮卫生高层次人才培养工程实施办法》,明确在5年内,全省分批培养50名领军人才、500名创新人才、1000名医坛新秀。《实施办法》将行政部门与单位共同作为培养主体,使培养方式、培养内容更加符合培养对象需求。培养对象的培养期限为5年。省财政设立专项资金,在培养周期内对领军人才、创新人才、医坛新秀分别给予100万元、40万元、5万元经费资助。培养对象所在单位按不低于1∶1的比例落实资助经费,并按规范程序核拨培养资金。
【昂立康】公司与苏州鹏旭、海晶生物和医溯源等三家公司签订《合作开发合同》及补充协议,对布瓦西坦项目进行合作开发,进一步共同开发研制原料药和制剂的生产工艺并申报相应的药品批文。
【广誉远】公司发行股份购买资产并募集配套资金之发行股份购买资产限售股6920.50万股将上市流通,上市流通日期为2019年12月23日。
【北大医药】公司进口仿制药生产场地改造建设项目获得项目财政补助资金186万元,该项目财政补助资金用于购置进口仿制药生产场地改造建设项目关键和重要的设备。
审评动向
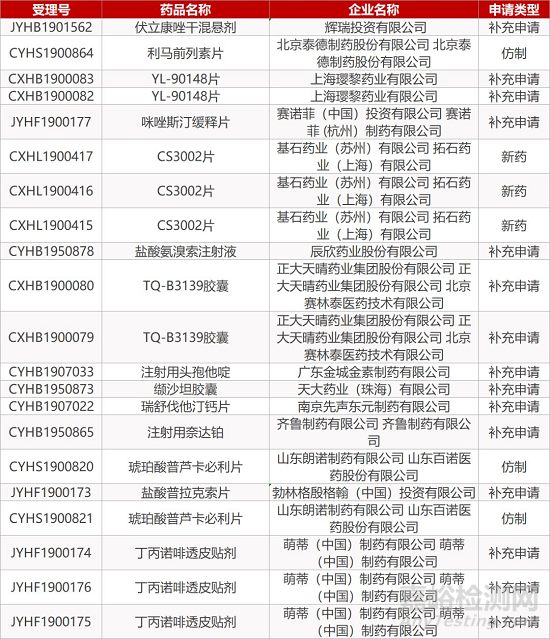
1. CDE最新受理情况(12月17日)
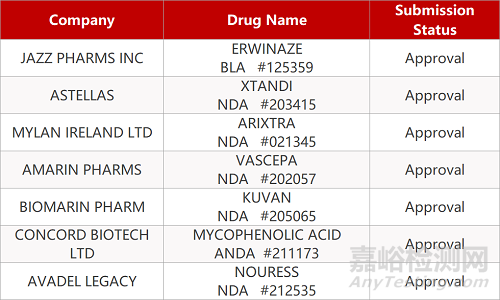
2. FDA最新获批情况(北美12月16日)

来源:药研发


