您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-31 09:14
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
修美乐在华收获第六个适应症。艾伯维修美乐(阿达木单抗注射液)获国家药监局批准,用于治疗对糖皮质激素应答不充分、需要节制使用糖皮质激素、或不适合进行糖皮质激素治疗的成年非感染性中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎患者。这是修美乐在华获批的第六个适应症,也标志着修美乐在中国继风湿免疫、皮肤、胃肠道领域和儿科之后,又进入了一全新的治疗领域——眼科领域。修美乐是目前中国唯一一个获批治疗成人非感染性中间、后、全葡萄膜炎的生物制剂。
1.京新药业左乙拉西坦片又有两规格通过一致性评价。京新药业左乙拉西坦片(0.5g、1.0g)获国家药监局核发的《药品补充申请批件》,该药品通过一致性评价。此前,京新药业该品种的0.25g规格产品已于2018年5月国内首家通过一致性评价。左乙拉西坦是比利时UCB公司研发的一种新型抗癫痫药物,于2006年11月获批进口中国,用于成人及4岁以上儿童癫痫患者部分性发作的加用治疗。据米内网数据,2018年中国公立医疗机构终端左乙拉西坦销售额10.39亿元。
2.索元生物抗肿瘤新药DB102在华获批临床。索元生物first-in-class丝氨酸/苏氨酸激酶抑制剂DB102(enzastaurin)联合标准疗法一线治疗胶质母细胞瘤(GBM)的国际Ⅱb期临床试验获NMPA批准。此前,FDA已于2019年9月批准开展该临床试验。在一项S008临床试验中,DB102联合标准治疗(替莫唑胺同步放化疗加辅助化疗)对于新诊断的GBM患者有更好的疗效,而且DGM1阳性患者的疗效显著优于DGM1阴性患者。DB102最初由礼来开发,索元生物拥有其全球开发权益。
3.养生堂PD-1单抗已通过I期临床审批。养生堂联合厦门大学研究团队研发的新一代肿瘤免疫治疗药物——“注射用重组人PD-1抗体单纯疱疹病毒”已通过国家药监局的临床试验审批,正在开展I期临床试验。据了解,该药物通过一种新的治疗机制——溶瘤病毒加免疫检验点抗体双管齐下共同发挥治疗效果。动物实验结果显示,该治疗机制对包括肝癌、结直肠癌在内的多种恶性肿瘤均有较好疗效。
4.康宁杰瑞与先声药业、思路迪达成战略合作。康宁杰瑞旗下江苏康宁杰瑞与先声药业、思路迪(北京)医药就其新一代PD-L1抗体药物KN035肿瘤适应症在中国大陆的商业化达成战略合作。根据协议,康宁杰瑞负责KN035的生产供应,思路迪医药负责KN035的临床开发、注册和市场销售,先声药业负责KN035在中国大陆注册上市后的独家商业推广,先声药业将向思路迪医药收取推广服务费。KN035是重组人源化PD-L1单域抗体Fc融合蛋白,由康宁杰瑞自主研发,2016年起与思路迪医药共同开发,有望成为全球首个上市的通过皮下注射给药的PD1/PD-L1抗体。
5.东阳光药2019年财报公布。东阳光药公布2019年业绩报告。全年营业收入62.2亿元,同比增长147.9%;经调整净利润20.9亿元,同比增长122.4%。财报显示,东阳光药5个品种(磷酸奥司他韦颗粒及胶囊、苯溴马隆片、替米沙坦片和莫西沙星片)营业额之和占总营业额的98.54%。其中,核心产品可威(磷酸奥司他韦)颗粒及胶囊销售额达到59.3亿元,同比增长164%。在新药研发方面,1类丙肝新药磷酸依米他韦已递交上市申请,甘精胰岛素及门东胰岛素临床试验工作已完成,预计今年申报上市。
1.氯喹类药物用于COVID-19患者获FDA紧急使用授权。FDA发布紧急使用授权(EUA),允许将捐赠给国家战略储备(SNS)的硫酸羟氯喹和磷酸氯喹产品分发并用于某些住院的COVID-19患者。这些药物将从SNS分发至各州,由医生酌情为住院的COVID-19青少年和成人患者开具处方。目前在一些国家,磷酸氯喹和硫酸羟氯喹被推荐用于治疗住院的COVID-19患者,并且许多国家指南报告纳入了关于在COVID-19患者中使用磷酸氯喹或硫酸羟氯喹的建议。
2.强生抗炎药Stelara在日获批新适应症。强生旗下杨森抗炎药Stelara(喜达诺®,乌司奴单抗)的新适应症获日本厚生劳动省批准上市。Stelara是一款IL-12/IL-23双靶向抑制剂,此次批准范围包括静脉输液剂型(用于中重度溃疡性结肠炎[UC]成人患者的诱导治疗,这些患者先前对常规或生物制剂应答不足或不耐受)和皮下注射剂型(用于中重度溃疡性结肠炎[UC]成人患者的维持治疗,这些患者先前对常规或生物制剂应答不足或不耐受)。
3.拜耳Eylea在日本获批第五个适应症。拜耳旗下日本子公司Bayer Yakuhin与Santen制药联合宣布,Eylea(aflibercept,阿柏西普)在日本获批一个新的适应症,用于治疗新生血管性青光眼(NVG)。Eylea是一种新型玻璃体内注射用VEGF抑制剂,此次批准涵盖Eylea小瓶装和Eylea预充式注射器。Eylea是全球首个治疗NVG的药物,NVG也是Eylea在日本批准的第5个适应症。另外4个适应症分别为:伴凹下脉络膜新生血管的年龄相关性黄斑变性、视网膜静脉阻塞继发黄斑水肿、病理性近视的脉络膜新生血管、糖尿病性黄斑水肿。
4.罗氏流感药物Xofluza新剂型上市申请及补充上市申请获受理。FDA受理罗氏(ROC)流感药物Xofluza(baloxavir marboxil)新剂型的上市申请(NDA),其口服混悬剂的单剂量颗粒(2mg/mL),用于治疗1岁至12岁以下健康儿童症状持续时间不超过48小的急性非复杂性流感,该剂型特别适用儿童以及有吞咽困难的人群。FDA还受理了2份补充新药申请(sNDA),寻求批准Xofluza,包括口服混悬剂和此前已获批的片剂,用于1岁及以上人群的流感暴露后预防。FDA预计将在2020年11月23日前做出审查决定。
5.阿斯利康达格列净III期DAPA-HF研究结果更新。3月28日,阿斯利康公布的III期DAPA-HF研究亚组分析最新数据显示,与安慰剂相比,达格列净降低了射血分数降低的心力衰竭(HFrEF)患者的心力衰竭恶化或心血管原因死亡构成的主要复合终点的发生率,无论背景疗法如何。研究结果在美国心脏病学会第69届年度科学会议和世界心脏病学大会(ACC.20/WCC)上公布,并发表在European Heart Journal上。目前,达格列净该适应症的补充新药申请已获FDA授予优先审评资格,预计在2020年第二季度获批。
6.杨森利伐沙班联合阿司匹林Ⅲ期临床结果积极。杨森Xarelto®(利伐沙班)联合阿司匹林在下肢血运重建后有症状的外周动脉疾病(PAD)患者中的VOYAGER PAD研究到达主要疗效和主要安全性终点:与用阿司匹林相比,联合疗法可将主要不良肢体和心血管(CV)事件的风险降低15%,而TIMI1大出血的发生率相似。该结果在美国心脏病学会第69届年度科学会议与世界心脏病学会(ACC.20 / WCC)上公布,并发表在《新英格兰医学》杂志上。
1.中国新冠治疗费用人均1.7万元。国家医保局公布治疗新冠肺炎患者的相关费用,截至3月15日,全国确诊患者结算人数为44189人,涉及总费用75248万元,人均费用1.7万元,其中医保支付比例约为65%(剩余部分由财政进行补助)。近日,美国卫生政策分析组织KFF发布一项研究显示,对于有重大并发症和合并症的新冠肺炎住院,平均总费用为20,292美元,折合人民币约14.4万元;没有并发症或合并症的患者的平均费用为9,763美元;对于所有入院患者,包括无并发症或合并症的患者,平均自付费用可能超过1300美元。
2.严厉打击非法制售新冠病毒检测试剂。国家药监局发布通知,要求各级药监部门加大对相关诊断试剂生产、经营企业、医疗器械网络交易服务第三方平台及网络销售企业的监督检查力度,及时组织查处违法违规线索,对未经许可从事生产、经营活动的,生产、经营未经注册批准相关检测试剂产品的,要依法从严从快查处。截至目前,国家药监局已批准了22个检测试剂产品注册上市,以满足疫情防控需要。
3.新研究发现排毒期长达49天新冠病例。3月27日,解放军中部战区总医院、陆军军医大学(第三军医大学)、解放军联勤保障部队第967医院等团队在医学预印本平台medRvix共同发文(未经同行审议),分析探讨了1例病毒排毒期(即在患者体内能够检测到新冠病毒RNA的时间)长达49天、但症状轻微的COVID-19(新冠肺炎)特殊病例情况。研究人员指出,该患者感染的病毒毒性较低,传播能力较弱,但携带病毒时间超长,或许是新冠病毒的新亚型。
【上海医药】公司及其全资子公司北方药业开发的“SPH4336片”临床试验申请获得国家药监局受理。
【华北制药】(1)2019年度实现营业收入108.81亿元(18.09%),实现归母净利润1.53亿元(1.86%),扣非归母净利润1.16亿元(413.86%)。(2)Wind一致增速-年报-Q4增速为无-(1.86%)-(-16.01%),扣非为无-(413.86%)-(320.17%)。
【誉衡药业】2020年3月27日,誉衡国际通过大宗交易方式减持公司股份4387.84万股,占公司总股本的2.00%。
2. FDA最新获批情况(北美3月26日)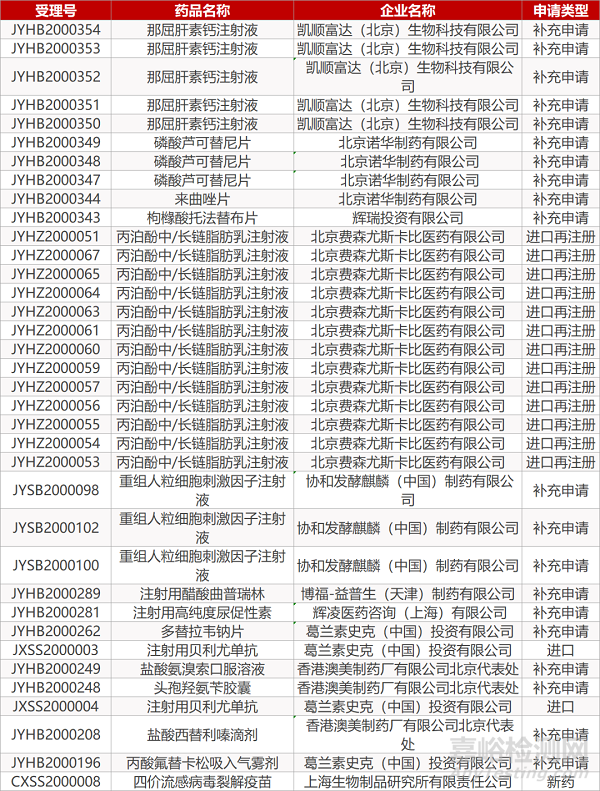
暂无
- The End -

来源:药研发


