医疗器械上市前的安全性及有效性评价非常重要,生物相容性评价是其中重要的组成部分。目前,我国已形成一整套与国际接轨的评价体系,即依据GB/T 16886(医疗器械生物学评价,等同采用ISO 10993)系列标准开展相关工作。GB/T 16886.1《医疗器械生物学评价 第1部分:风险管理过程中的评价和试验》是系列标准中的总则,给出了医疗器械生物学评价的原则和策略,其他18个部分规定了各项具体评价试验的专项要求和试验方法。
GB/T 16886.6-2015/ISO 10993-6:2007《医疗器械生物学评价 第6部分:植入后局部反应试验》[1]是我国评价长期植入人体医疗器械对机体局部刺激等影响的现行有效标准。因国家标准等同采用国际标准存在转化周期的问题,所以常会出现我国现行有效标准并非国际标准的最新版本,即国家标准采标版本滞后于国际标准。ISO 10993-6:2016[2]是目前该国际标准的最新版本,版本更替中有部分实质性内容的变化,这将带来我国医疗器械生物相容性评价与国际标准的接轨问题,影响相关产品的外销出口;同时,因新标准已在转化过程中,所以国内相关生产企业应及早关注标准的变化内容,提前着手评估产品是否符合新标准的要求,在标准转化过渡期内做好准备,确保顺利通过产品的相关评价。
1 ISO10993-6:2016与2007版的主要变化及应重点关注的问题
1.1 新增脑植入的试验要求和方法
脑植入在2007版标准中未作说明和要求,在2016版附录D中给出了较详细的试验方法。与脑部及神经组织接触的器械产品需进行脑植入试验评价,重点关注内容包含以下几点。
1.1.1 实验动物的选择及植入部位
在进行皮下、肌肉、骨植入等试验时,无需关注动物的性别;在进行脑植入试验时,要考虑动物性别对试验的影响,不同性别的动物对植入脑部的材料或器械可能会产生不同的反应,因此,试验要选用两个性别的动物,或在通过文献或历史经验确认待评价植入物对机体的影响与动物性别无关时,可选择单一性别的动物进行试验。
在进行非脑植入试验时,为消除动物之间的个体差异,同一只动物相应部位的左右两侧应分别植入试验样品和对照品;但在进行脑植入试验时,一只动物只能植入试验样品或对照品其中之一,并且在一次试验中只能选择实验动 物大脑同一侧(左侧或右侧)相同特定部位植入样品,以免由于手术或植入物带来脑组织损伤而表现出不同的病理改变(左右脑的功能不同),导致无从判断试验样品本身对神经组织造成的影响。
1.1.2 植入周期的选择
在进行脑植入试验时,因神经病变发生迅速,所以必须选择短周期(1周)。对于长周期的选择,标准中并未给出更具体的要求,这些周期的设计要根据临床应用而定,应能评估临床应用中可能存在的风险。
1.1.3 特殊的病理生理反应
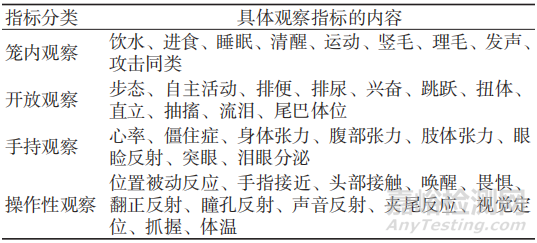
植入物脑组织中的占位或刺激作用会引起特殊的神经反应,其他部位植入试验不存在此问题。脑组织植入异物后,有可能产生的神经躯体症状通常采用功能观察组合试验(functional observation battery,FOB)[3]进行评估,见表1。
表1 FOB的指标
在评价植入物引起脑组织局部刺激的组织病理观察时,其基本评分方式与其他部位植入后局部反应相似,但神经系统反应有其特殊性,经常需要借助特殊的免疫组化染色来进一步明确神经细胞和(或)周围组织的病变。
1.2 关注可降解吸收材料的植入试验
随着可降解吸收医疗器械产品的不断研发推出,对该类产品植入体内后的生物学行为的研究日益得到重视。在GB/T 16886.6-2015/ISO 10993-6:2007中已有关于可降解器械体内植入的要求和试验方法,但其部分试验策略以资料 性附录的方式提出,在ISO 10993-6:2016版中将该部分内容置于正文中予以要求。
关于可降解吸收材料的植入试验需要关注以下几点。
1.2.1 植入部位的标记
植入物可降解并被机体吸收,在植入周期末解剖时,将给准确取材植入带来很大的困难,因此,宜在植入物旁不影响被检物的位置植入非降解的阴性材料作为标识,如非降解的手术缝合线。取材时要注意识别方位,如果要移除标记物,注意不要损伤待测植入物周围的组织。检验机构应有标准化的操作程序,以保证试验过程的可重复性和检验结果的准确性。
1.2.2 试验周期的设计
对于非降解的器械,标准中推荐植入试验的周期一般为1、4、12周,基本涵盖植入后局部组织的炎症期和纤维组织化期;但对于可降解吸收的器械,试验周期的设计应考虑材料的降解特性,一般应包含早期1~2周、中期代表降 解典型阶段的多个时间点,及晚期仅存在微量植入物且组织接近修复的阶段。
如果植入物降解周期很长,试验结束时植入物未完全降解,则需报告剩余植入物的比例。对于降解周期长的植入物,为了更好地评估其降解晚期对机体造成的影响,可考虑在体外采用加速的方法制备一部分降解(如50%)的材料,再植入动物体内,如此有可能获得植入物完全或接近完全降解时周围组织的反应情况。
1.2.3 多种材质组成的器械
在进行由多种材质组成器械的植入试验时,植入物中应包含该器械的所有组分,并需考虑不同组分的降解特性,在设计试验周期时应涵盖这些要素。
1.2.4 含药或有涂层的可吸收器械
在采用植入试验评价该类产品的局部刺激性时,通用 的试验方案可能不适用,宜考虑药物的影响。
2应对措施
面对标准发生的变化,相关企业及准备开展相关评价的检验机构都应该积极准备,以保证新标准顺利实施。
2.1 生产企业
脑组织植入试验是新增加的内容,对样品的形状尺寸有特殊的要求。为了减轻对脑组织的损伤,样品宜为圆棒或楔形,如果实验动物是大鼠或兔,则样品截面积应不大于1 mm×1 mm,长度介于2~6 mm ;如果是圆片,则要求样品直径不大于8 mm,厚度取决于实际所用的材料。样品的数量每个植入周期不能少于8个。企业宜在设计开发之初 即考虑能代表成品特性的检验用样品的加工制作。
生产可降解吸收医疗器械的企业应对所用材料的降解特性有较深入的了解,如果是新材料,则可利用啮齿类小动物开展降解特性的预实验,以指导最终试验方案的制定;如果非新材料,则需进行广泛的文献调研,尽可能利用已 有的信息,避免不必要的重复试验,根据文献信息设计合理的植入试验周期。
2.2 检验机构
检验机构应及早透彻学习、掌握新标准,并通过前期实验研究,寻找和确定该实验室稳定、可重复的实验方法与技术,以保证检验机构检测结果的权威性。
非降解样品的植入试验可以按照标准推荐的周期进行检测,对于可降解吸收的样品,在进行植入试验研究时,要与委托方充分沟通,了解降解周期,以便进行科学合理的检验工作。
脑组织植入试验对于拟开展该试验的机构是很大的挑战,检测机构的技术人员应在以下几个主要方面做好准备:(1)购置脑部立体定位仪器,掌握脑部功能团的分布,尽可能在试验时避开重要的神经功能团,保证试验顺利地进行;(2)进一步确认麻醉方式的有效性,在操作过程中要使动物处于良好的麻醉状态;(3)反复练习,保证操作技术的娴熟精准;(4)掌握中枢神经系统功能异常的观察及评分方法;(5)脑组织取材时要采用灌注固定法,以免其细胞组织快速发生自溶而干扰试验结果;(6)筹备开展神经组织的特殊免疫组化染色。
3 植入试验评价中的关键问题
在开展植入试验的日常工作中,受样品多样性的影响,可能会遇到试验设计合理性待确认的情况,常见的问题包含以下几点。
3.1 对照品的选择
在植入试验中,试验样品对组织局部的刺激性通过比较其与阴性对照品引起组织反应程度的差值表示,因此,对照品的选择尤为重要。当选择 GB/T 16886.12《医疗器械生物学评价 第12部分:样品制备与参照样品》[4]中推荐的经典阴性对照品时,可依据 GB/T 16886.6中给出的组织评分系统进行半定量评分,计算组织病理平均记分,按无刺激、轻微刺激、中度刺激和重度刺激表示试验样品对组织的刺激程度。
当无合适阴性对照品可用而采用已上市同类产品作为对照品时,一定要关注对照品本身对周围组织的刺激作用,避免“越比越差”,即通过试验组和对照组病理记分的差值而忽略较高的背景值信息。如果对照品本身病理评分较高,则需慎重做出试验样品“无刺激”的结论,应指出该结果是与已上市的同类产品比较得出,需综合其收益风险情况决定是否接受该试验结果。
3.2 植入组织类型的选择
标准中样品的植入部位包含皮下、肌肉、骨骼和脑部 组织,选择植入部位的基本原则是结果待评价医疗器械的预期使用用途。通常,骨骼和脑部组织会限定为在特定部位使用的医疗器械,不会出现争议。
选择皮下、肌肉组织情况会比较复杂,除了尽量贴近临床使用部位或组织类型的原则,有时还要考虑风险暴露是否充分,如通常认为肌肉组织比皮下组织血供更充分,因此,试验样品植入肌肉组织的结果应更加敏感;对于具有潜在免疫原性的样品,一般认为,相较于肌肉组织,抗原由皮下组织进入机体更易引发免疫应答,但亦有认为肌 肉途径更敏感[5-6],可能与抗原类型有关。
3.3 植入周期与组织反应的类型
依据标准中给出的推荐方案选择植入周期,应至少涵盖长短两个周期。如果待评价医疗器械预期在体内停留时间不超过4周,则植入周期的选择应能评估各个典型阶段对局部组织的风险。需要注意的是,在植入1周取材时,受手 术创伤的影响,可能会存在阴性对照背景较高的情况,需客观评价试验结果。
通常,植入试验早期(4周内)的组织反应以炎症反应为主,9~12周炎症反应会逐渐消失,但如果植入物具有免疫原性,则植入物周围的细胞反应(浆细胞等免疫细胞)会持续到12周或更久(26周)。
4结语
面对包含很多新内容的即将转化的国家标准,各方需积极准备以适应新要求,应不断加深对标准的理解,做到具体产品具体分析,制定科学合理的评价方案。
【参考文献】
[1]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 16886.6-2015/ISO 10993-6:2007 医疗器械生物学评价 第6部分:植入后局部反应试验[S/OL].(2015-1210)[2017-04-01].
http://www.csres.com/detail/278215.html.
[2]ICS.ISO 10993-6:2016 Biological evaluation of medical devicesPart 6:Tests for local effects after implantation[S/OL].(2016-1201).
https://www.iso.org/standard/61089.html.
[3]李欣,姚景春,李涛,等.功能观察组合试验(FOB)评价牛蒡子苷元对大鼠中枢神经系统的影响[J].中华中医药学刊,2015,33(2):441-443.
[4]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 16886.12-2017 医疗器械生物学评价 第12部分:样品制备与参照样品 [S/OL].(2017-12-29)[2018-07-01].
http://www.csres.com/detail/308502.html.
[5]徐志伟,徐小波,于建宁,等.羊抗人ApoB高效价抗血清制备方法的建立与优化 [J].江苏农业科学,2018,46(23):180-182.
[6]周光炎.免疫学原理[M].4版.北京:科学出版社,2018:82.