您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-23 09:47
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.新版《生物制品批签发管理办法》发布。国家市场监督管理总局发布《生物制品批签发管理办法》,自2021年3月1日起施行。相比2018年版本,主要修改了三项内容:一是明确批签发职责分工和批签发机构等的职责,完善重大质量风险产品查处程序。二是规范批签发管理要求,明确批签发豁免情形、检验项目和频次要求,强化生产工艺偏差管理。三是落实上市许可持有人主体责任,强化全生命周期管理要求。
2.正大天晴安罗替尼第4个适应症即将获批。正大天晴1类新药安罗替尼第4个适应症的上市申请已变更为"在审批",预计近期获批上市,单药用于无法手术的局部晚期或转移性甲状腺髓样癌患者的治疗。盐酸安罗替尼(商品名:福可维)是正大天晴自主研发的一款新型小分子多靶点酪氨酸激酶抑制剂,此前已获批3个适应症,分别是三线治疗非小细胞肺癌(NSCLC)、三线治疗小细胞肺癌(SCLC)以及二线治疗软组织肉瘤。
3.杨森/传奇生物CAR-T疗法向FDA滚动申报上市。杨森与传奇生物合作开发的BCMA靶向CAR-T疗法ciltacabtagene autoleucel(cilta-cel)向FDA滚动提交了生物制品许可申请,用于治疗复发/难治性多发性骨髓瘤成人患者。一项在ASH2020年会上公布的Ⅰb/Ⅱ期临床CARTITUDE-1数据显示,在中位随访为12.4个月时,cilta-cel在这类患者中的ORR达到97%,有67%的患者达到完全缓解;患者的中位缓解持续时间和无进展生存期均尚未达到。
4.荣昌生物泰它西普治疗IgA肾病美国获批临床。荣昌生物融合蛋白药物泰它西普(RC18)治疗免疫球蛋白A(IgA)肾病的临床试验申请获FDA批准,可在美国免做I期研究,直接开展II期临床研究。RC18是荣昌生物自主研发的同类首创BLyS/APRIL双靶向TACI-Fc融合蛋白,主要开发适应症为系统性红斑狼疮(SLE)。在美国,泰它西普治疗SLE的注册性临床试验于今年1月获得FDA批准,并于4月被授予快速通道资格。荣昌计划2021年上半年开展治疗SLE的全球性III期临床研究。
5.兆科眼科申请港交所IPO。李氏大药厂旗下兆科眼科向港交所提交了IPO招股书,联席保荐人为高盛和Jefferies。兆科眼科是一家眼科制药公司,拥有由23种药物组成的眼科药物管线,其中包括环孢素A眼凝胶、RGN-259(胸腺素β4)等11种创新药物,涵盖干眼病、湿性老年性黄斑变性、糖尿病性黄斑水肿、近视等适应症。该公司拟募集资金用于其核心产品的临床开发及商业化;其他在研候选药物的持续研发活动及商业化;以及扩张南沙生产线等等。
国际药讯
1.Blueprint精准KIT抑制剂avapritinib在美申请新适应症。Blueprint Medicines公司小分子新药Ayvakit(avapritinib)已向FDA提交了补充新药申请,并申请优先审评,用于治疗晚期系统性肥大细胞增多症(SM)。Ayvakit是一款D816V靶向KIT抑制剂,已获FDA授予治疗晚期SM(包括侵袭性SM、SM伴相关血液肿瘤和肥大细胞白血病)的突破性疗法认定,目前正在进行治疗晚期和惰性SM的全球临床研究。此前,Ayvakit已在美国和欧洲获批用于治疗PDGFRA突变的不可切除或转移性胃肠道间质瘤成人患者。
2.罗氏VEGF-A/Ang-2双抗Ⅲ期临床结果积极。罗氏VEGF-A/Ang-2双抗faricimab治疗糖尿病性黄斑水肿(DME)的两项国际Ⅲ期临床均达到主要临床终点指标。每隔8周接受faricimab的注射与已获批VEGF抑制剂相比,达到非劣效性标准。同时个体化给药组中超过一半的受试者在第一年接受治疗时,治疗的间隔时间延长到16周。这是治疗DME的在研药物首次在Ⅲ期临床中达到这种持久性水平。
3.Exelixis多激酶抑制剂Ⅲ期临床结果积极。Exelixis公司宣布其多靶点酪氨酸激酶抑制剂Cabometyx(cabozantinib)治疗放射性碘难治性分化型甲状腺癌的关键性Ⅲ期临床COSMIC-311达到共同主要终点。中期分析显示,与安慰剂相比,接受Cabometyx治疗的患者疾病进展或死亡风险降低78%(HR=0.22, 96% CI, 0.13-0.36,p<0.0001)。独立数据监查委员会建议提前揭盲。Cabometyx此前已获FDA批准用于治疗晚期肾细胞癌患者和既往接受索拉非尼治疗的肝细胞癌患者。
4.勃林格殷格翰新冠中和抗体研究进入临床试验阶段。12月18日,科隆大学医院、马尔堡大学、德国感染研究中心和勃林格殷格翰联合宣布启动一款全新的新冠中和抗体BI 767551的Ⅰ/Ⅱa期临床(NCT04631705与NCT04631666)研究。BI 767551源自科隆大学医院新冠肺炎患者的血液样本,在马尔堡大学开展新冠病毒中和检测,并与勃林格殷格翰进一步合作开发。这项临床将由科隆大学医院的Florian Klein教授及Gerd Fätkenheuer教授负责领导,勃林格殷格翰将提供该抗体。
5.默沙东联手Janux 公司开发下一代TCE免疫疗法。Janux Therapeutics与默沙东达成战略合作,将利用Janux的专利TRACTr技术共同开发下一代TCE免疫疗法。在临床前研究中,Janux TRACTr候选药物相对于标准的T细胞激活剂表现出类似的抗肿瘤功效,而且没有与细胞因子释放、健康组织毒性或全身免疫激活相关的数据。根据协议,默沙东将为该合作提供研发资金,有权自主选择肿瘤治疗靶点,并享有合作产品的独家选择权益;Janux有可能获得每个目标产品最多5.505亿美元的上限付款。
6.GSK与Ligand合作开发神经系统疾病疗法。葛兰素史克(GSK)与 Ligand Pharmaceuticals子公司Icagen达成合作协议,将利用Icagen公司在靶向跨膜蛋白小分子疗法方面的专利技术,识别与神经系统疾病相关的特定基因靶标分子并开发相应抑制剂药物。根据协议,Ligand将获得700万美元的预付款,不超过1.545亿美元的开发,监管和商业化里程碑付款,以及合作产品的销售分成;GSK拥有任何潜在抑制剂的独家许可选择权,并将负责该候选药物的进一步开发和商业化过程。
医药热点
1.人类表型组计划发展报告发布。中国人类表型组研究协作组、上海国际人类表型组研究院、复旦大学人类表型组研究院联合编撰的《人类表型组计划发展报告2020》近日在2020复旦科技创新论坛上发布。《报告》提出,未来将优先聚焦“新冠肺炎和其他重大疾病的表型组学研究”“表型组研究技术体系与科研基础设施构建”“表型组学研究中的标准操作程序”三大方向。
2.中国医院协会心脏康复管理专业委员会成立。12月18日,中国医院协会心脏康复管理专业委员会成立大会暨学术交流会在北京举办。会议选举出中国医院协会心脏康复管理专业委员会第一届委员会委员231名,常务委员63名。北京大学第一医院霍勇教授当选主任委员,高炜教授等8人担任副主任委员,徐亚伟教授担任秘书长。
3.国内首个mRNA新冠疫苗生产车间开建。国内首个mRNA新冠疫苗生产车间建设奠基仪式在云南玉溪市高新区疫苗产业园举行。该车间依托云南沃森生物已有良好的疫苗生产配套设施,以及成熟稳健的生产质量管理体系,预计开工后8个月内将建成投入运营。该mRNA新冠疫苗产业化建设项目投资2.8亿元,一期产能为1.2亿剂/年。据悉该新冠mRNA疫苗(ARcoVax)由军事科学院军事医学研究院、艾博生物与沃森生物共同研制。
股市资讯
【海辰药业】公司引进的IDH抑制剂临床前候选化合物(PCC)交付完成。
【健友股份】苯磺顺阿曲库铵注射液(规格:5ml:10mg)获批上市。
【贵州百灵】芍苓片寻常型银屑病适应症获批临床。
审评动向
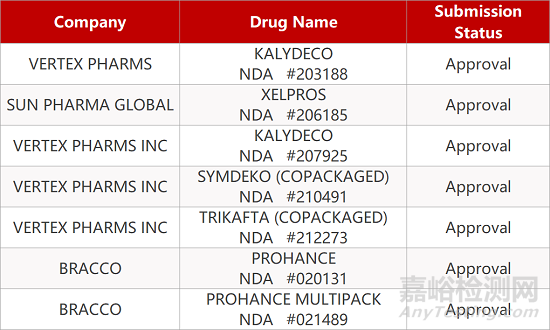
1. CDE最新受理情况(12月22日)
暂无
- The End -

来源:药研发


