您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-24 09:23
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:14条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.和黄医药索凡替尼即将获批。和黄医药新型口服酪氨酸激酶抑制剂「索凡替尼胶囊」的上市申请(CXHS1900034)进入行政审批阶段,有望近期获批上市,用于治疗晚期非胰腺神经内分泌瘤。据悉,索凡替尼目前已在国内递交了用于治疗晚期非胰腺神经内分泌瘤和用于治疗晚期胰腺神经内分泌瘤的两个上市申请。在美国,FDA已授予索凡替尼治疗胰腺和非胰腺神经内分泌瘤的快速通道资格,以及治疗胰腺神经内分泌瘤的孤儿药资格。该公司计划将在欧美同步递交索凡替尼的上市申请。
2.康宁杰瑞皮下注射PD-L1申报上市。NMPA受理了先声药业与康宁杰瑞、思路迪医药合作开发的皮下注射PD-L1单抗KN035的上市申请,用于治疗MSI-H╱dMMR晚期实体瘤患者。在一项中国II期临床中,KN035在这类癌症患者中的ORR为42.7%(n=103)。结肠直肠癌(n=65)、胃癌(n=18)及其他癌症(n=20)的患者的ORR经设盲的独立评审委员会评估及确认后分别为43.1%、44.4%及40.0%。KN035目前正在中国、美国和日本针对多个肿瘤适应症进行临床开发。
3.绿叶精分症新药LY03010在美启动关键性临床。绿叶制药棕榈酸帕利哌酮缓释混悬注射液(LY03010)用于治疗精神分裂症和分裂情感性障碍的关键临床试验方案获FDA批准。LY03010是一种缓释混悬注射液,每月给药一次,以肌肉注射的方式用于精神分裂症和分裂情感性障碍的治疗,可改善口服抗精神病药物在这类患者中普遍存在的用药依从性。目前LY03010在美国已进入关键性临床开发阶段。
4.华海双特异融合蛋白HB0025注射液美国获批临床。华海旗下华奥泰自主研发的融合蛋白HB0025注射液的临床试验申请获FDA批准。HB0025是全球首个获批进入临床、能同时阻断PD-1/PD-L1和VEGF/VEGFR这两条信号通路的双特异性融合蛋白。目前全球范围内尚无同类药物获批上市,罗氏开发的Atezolizumab(抗PD-L1单抗)和 Bevacizumab(抗VEGF单抗)联用疗法已被FDA和NMPA批准用于治疗不可切除的肝细胞癌,该组合联合化疗也被FDA批准用于一线治疗无EGFR或ALK突变的转移性非鳞状非小细胞肺癌。
5.药明生物收购拜耳旗下德国生物药原液厂。药明生物与拜耳达成一项收购协议,将收购拜耳位于德国伍珀塔尔的生物药原液厂,并计划签订长期转租协议和过渡服务合同,交易总金额约为1.5亿欧元。此次收购的生物药原液厂(药明生物原液十九厂,MFG19)面积达3万平方米,包括3条1000升灌流和6条2000升流加生产线以及独立的下游配套设施,将进一步提升药明生物对于新冠疫苗及其他生物药的全球供应能力。
国际药讯
1.EMA有条件批准辉瑞/BioNTech新冠疫苗上市。欧洲药品管理局(EMA)21日宣布,"有限许可"辉瑞与BioNTech共同研发的新冠疫苗上市,为期一年。欧盟委员会将向BioNTech/辉瑞采购2亿支疫苗针剂,并保留另外1亿支的购买权利。EMA执行主任库克库克认为,无迹象显示BioNTech/辉瑞疫苗对新近(英国)出现的变异新冠病毒无效。德国计划于12月27日率先在高危人群中接种这款疫苗。
2.FDA批准第二款埃博拉疗法。FDA批准Ridgeback Biotherapeutics公司单抗药物Ebanga(ansuvimab-zykl)上市,用于治疗成人和儿童的埃博拉病毒感染。这是继再生元公司中和抗体鸡尾酒疗法Inmazeb(atoltivimab、maftivimab和odesivimab-ebgn,曾用名REGN-EB3)在今年10月获批上市之后,FDA批准的第二款治疗埃博拉病毒感染的疗法。在2018-2019年刚果埃博拉疫情期间,与对照治疗相比,Ebanga单次静脉输注降低了确诊患者28天后的死亡率(35.1%vs49.4%)。
3.欧盟批准首款长效HIV注射疗法上市。ViiV Healthcare整合酶抑制剂Vocabria(卡博特韦注射液和片剂)获欧洲药品管理局批准,与杨森Rekambys(利匹韦林注射液)和Edurant(利匹韦林片剂)联用,治疗曾接受抗逆转录病毒治疗方案且达到病毒学抑制的HIV-1感染成人患者。在关键性Ⅲ期临床试验ATLAS、FLAIR和ATLAS-2M中,每月注射1次卡博特韦和利匹韦林在维持病毒抑制方面与继续每日1次口服抗逆转录病毒治疗方案同样有效。而且ATLAS-2M数据显示,每2个月使用一次卡博特韦和利匹韦林长效注射液的抗病毒活性和安全性与每月一次给药相比,达到非劣效性标准。
4.Rhythm创新减肥疗法Ⅲ期临床结果积极。Rhythm公司MC4R激动剂setmelanotide治疗因Bardet-Biedl综合征(BBS)或Alström综合征导致持续饥饿和严重肥胖的关键性Ⅲ期临床达到主要和所有关键性次要终点。接受治疗约52周时体重相对基线减轻至少10%(p=0.0024)的患者比例达到34.5%(n=31);患者体重与基线相比平均下降-6.2%(p<0.0001),饥饿评分较基线相比平均降低-30.8%(p<0.0001),而且有60.2%的患者的饥饿评分较基线至少降低25%(p<0.0001)。该公司将完成BMI和BMI-Z评分的进一步分析。
5.IL-15激动剂联合卡介苗治疗膀胱癌临床数据积极。ImmunityBio公司宣布IL-15激动剂N-803(Anktiva)治疗非肌层浸润性原位膀胱癌关键II/III期试验(QUILT3.032)的首个队列研究获积极结果。在可评估患者中,卡介苗联合N-803治疗组患者完全缓解率达72%(51/71,任意时间),其中59%的患者的完全缓解时间持续12个月以上;完全缓解的中位持续时间为19.2个月;有1%的患者报告出现严重不良事件,但均与治疗无关。ImmunityBio计划明年向FDA提交其生物制品许可申请。
6.葛兰素史克联手Sosei开发小分子激动剂GPR35。葛兰素史克与Sosei集团签订全球合作协议,将利用Sosei集团旗下Sosei Heptares的稳定受体(StaR®)技术和药物设计(SBDD)平台,开发用于炎症性肠道疾病(IBD)和其他胃肠道免疫紊乱疾病的GPCR靶向GPR35激动剂药物组合(包括一款创新的先导临床前化合物和多种不同的候选化合物)。根据协议,Sosei Heptares将获得高达4400万美元的研究资金、预付款和近期开发里程碑付款,最高可达4.37亿美元的开发、监管和商业化里程碑付款,以及合作产品的销售分成。
医药热点
1.国家呼吸医学中心正式挂牌。12月22日,国家呼吸医学中心在广州医科大学附属第一医院正式挂牌,由钟南山院士担任名誉主任,并启动了与首批26家广东地区协同医院的合作。此前,国家卫健委决定以广州医科大学附属第一医院和中日友好医院为主体分别设置国家呼吸医学中心。目前,广州医科大学附属第一医院的国家呼吸医学中心I期工程已经交付使用。
2.第二批抗癌药和罕见病药品原料将实行零关税。12月21日,国务院关税税则委员会印发关于2021年关税调整方案的通知。自2021年1月1日起,我国将对883项商品实施低于最惠国税率的进口暂定税率。其中医药类相关的包括:第二批抗癌药和罕见病药品原料、特殊患儿所需食品等实行零关税,降低人工心脏瓣膜、助听器等医疗器材以及乳清蛋白粉、乳铁蛋白等婴儿奶粉原料的进口关税。
股市资讯
【普利制药】注射用比伐芦定获得美国FDA暂时批准。
【天坛生物】1)成都蓉生皮下注射人免疫球蛋白(注射液)临床实验获批。2)永昌兰生获得单采血浆许可证。
【润都股份】厄贝沙坦氢氯噻嗪片获得药品注册批件。
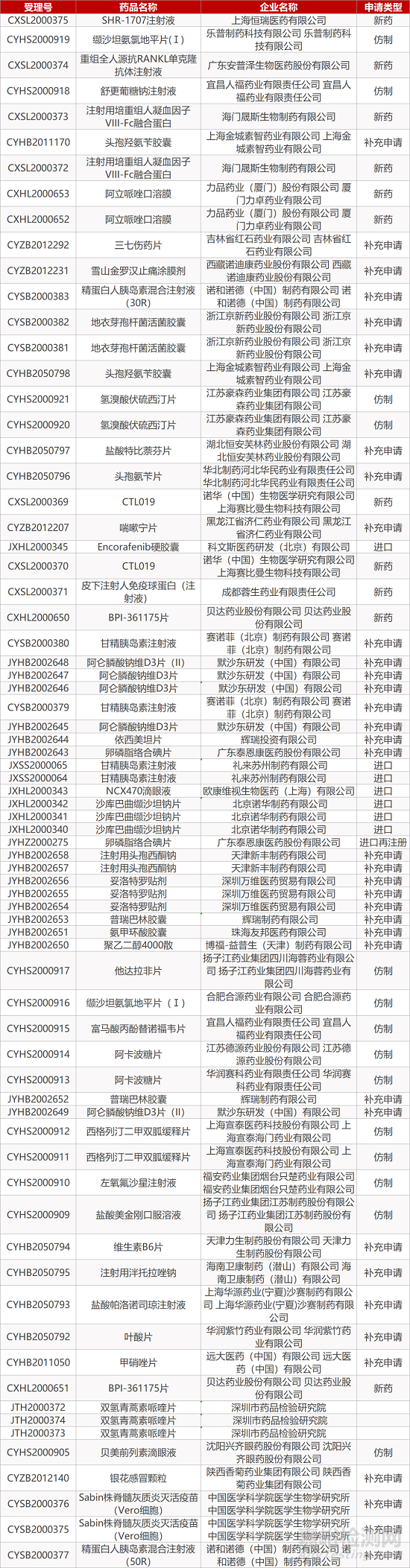
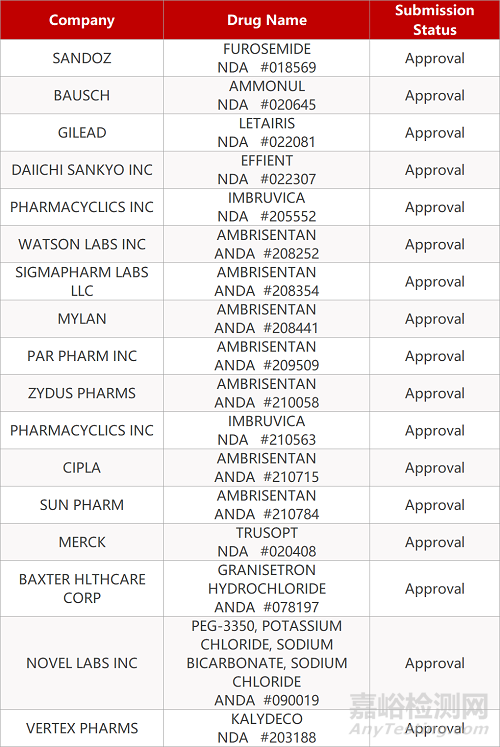
审评动向
- The End -

来源:药研发


