您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-28 10:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.苑东生物硫酸氢氯吡格雷片通过一致性评价。苑东生物4类仿制药硫酸氢氯吡格雷片获国家药监局批准并视同通过一致性评价。硫酸氢氯吡格雷片是一种血小板聚集抑制剂,是抗血栓形成药市场的明星品种,在中国公立医疗机构终端销售额超过100亿元规模。目前国内该品种已有信立泰、乐普药业等10家企业通过一致性评价。随着国内药企的频频发力,原研厂家赛诺菲的市场份额占比已跌破50%。
2.恒瑞CDK4/6抑制剂达Ⅲ期临床主要终点。恒瑞医药CDK4/6抑制剂SHR6390片治疗晚期乳腺癌的Ⅲ期临床SHR6390-III-301达主要研究终点。该试验评估SHR6390联合氟维司群对比安慰剂联合氟维司群治疗既往接受内分泌治疗后疾病进展的HR+、HER2-局部晚期或晚期转移性乳腺癌的效果。结果表明:与安慰剂联合氟维司群相比,SHR6390联合氟维司群可显著延长患者的无进展生存期。该公司计划向CDE递交其上市申请。
3.拜耳PI3K抑制剂拟纳入突破性疗法认定。拜耳Copanlisib注射用冻干制剂获CDE拟纳入突破性疗法认定,用于治疗既往接受过至少两线治疗的复发性边缘区淋巴瘤(MZL)。Copanlisib是一款PI3K抑制剂,此前已获FDA批准用于治疗先前接受过两种以上治疗的滤泡性淋巴瘤患者。在一项关键性II期研究CHRONOS-1中,Copanlisib在MZL患者中的总体缓解率(ORR)为60.6%,MZL组织学ORR达到78.3%。
4.新型心肌肌球蛋白抑制剂中国获批临床。Cytokinetics公司与箕星药业联合申报的1类新药CK-3773274(CK-274)片获国家药监局两项临床试验默示许可,拟开发用于梗阻性肥厚型心肌病(HCM)。CK-274是Cytokinetics公司开发的一款新型口服小分子心肌肌球蛋白抑制剂,已在Ⅰ期研究健康受试者中显示出良好的安全性和耐受性,目前正在美国Ⅱ期临床中评估治疗梗阻性HCM患者的潜力。箕星药业拥有CK-274在大中华区的研发和商业化权益。
5.默沙东PD-1联合疗法在华申报临床。默沙东1类新药MK-1308A注射液的临床试验申请获CDE受理。根据公开资料,MK-1308A是MK-1308和pembrolizumab的联合治疗方案,其中MK-1308是默沙东从康方生物引进的一款抗CTLA-4抗体,pembrolizumab是默沙东的明星抗癌药PD-1抑制剂Keytruda。一项在IASLC2020大会上公布的Ⅰ/Ⅱ期临床结果显示,这一联合疗法在晚期非小细胞肺癌(NSCLC)患者中整体ORR为35.1%;中位PFS为6.1个月,6个月时的PFS率为54%;中位OS为16.5个月,12个月时的OS率为67%。
6.嘉和生物引进品种CDK4/6抑制剂申报临床。嘉和生物与G1 Therapeutics的合作品种lerociclib片的临床试验申请获CDE受理。lerociclib是G1 Therapeutics开发的一款潜在“best-in-class”口服CDK4/6抑制剂。根据clinicaltrials.gov网站,目前,该产品正在开展两项Ⅰ/Ⅱ期临床试验,分别针对乳腺癌和非小细胞肺癌(NSCLC)。今年6月,嘉和生物与G1 Therapeutics达成独家许可协议,获得了lerociclib在亚太地区(日本除外)的专有开发和商业化权利。
国际药讯
1.盘点2020年FDA批准的新药。截至2020年12月25日,FDA今年共批准53款新药(包括39个新分子实体和14个新生物制品),创新药数目仅次于2018年创纪录的59款;获批的肿瘤药占比最高(34%,18/53),其他占比较高的疾病领域还包括神经(15%,8/53)、内分泌代谢(9%,5/53)、诊断试剂(7%,4/53)、感染性疾病(7%,4/53);获批的注射剂最多(50%,26/53),其次是普通口服片剂和胶囊剂;有26个新药是以“优先审评”的方式获批(包括23个新分子实体和3个新生物制品),有31个品种获“孤儿药”资格,占所有获批新药的58%。
2.艾伯维伊布替尼获FDA更新处方信息。FDA批准艾伯维伊布替尼(Imbruvica,亿珂)更新处方信息,纳入Ⅲ期研究(iNNOVATE)伊布替尼联合利妥昔单抗治疗华氏巨球蛋白血症(WM)的长期疗效和安全性数据。该疗法于2013年首次获批,目前可用于治疗若干类型的血液癌症以及慢性移植物抗宿主病。基于iNNOVATE研究的结果,Imbruvica于2015年获批单药治疗WM,并于2018年获批与利妥昔单抗联合治疗WM。
3.Amryt罕见皮肤病基因疗法AP103获FDA孤儿药资格。FDA授予Amryt公司非病毒载体基因疗法AP103孤儿药资格,用于治疗营养不良型大疱性表皮松解症(营养不良型EB)。EB是一组以皮肤脆性增加及创伤后水疱形成为主要表现,伴有多系统严重并发症的罕见遗传性皮肤病。AP103可使用高度支化聚β-氨基酯(HPAE)作为递送载体,将正确的VII型胶原蛋白基因递送至皮肤细胞中,以达到治愈目标。
4.Allogene同种异体CAR-T疗法ALLO-715获FDA临床批准。FDA批准Allogene Therapeutic公司BCMA靶向同种异体CAR-T疗法ALLO-715的临床试验申请,与SpringWorks公司在研γ-分泌酶抑制剂nirogacestat联用,治疗复发/难治性多发性骨髓瘤(MM)。临床前研究表明,nirogacestat可阻止BCMA的裂解和脱落,导致BCMA在细胞表面的密度增加,具有增强ALLO-715治疗潜力的作用。两家公司预计在明年第一季度开展Ⅰ期研究,评估该组合疗法的安全性、耐受性和初步疗效。
5.RegenxBio出售Zolgensma部分专利使用权。RegenxBio拟以2亿美元的价格向Healthcare Royalty(HCR)公司出售其一次性基因疗法Zolgensma的部分专利权。Zolgensma是由AveXis公司(已被诺华收购)基于Regenxbio的NAV技术平台和AAV9载体开发的、全球首个获批治疗脊髓性肌萎缩症(SMA)的基因疗法,目前市场定价为210万美元,被称为世界上最昂贵的药物。此次的交易资金,RegenxBio将用于支持其他罕见神经退行性疾病的药物研发进度和建立新的生产设施等。
6.安进放弃麻风和结核病产品权利。安进与澳大利亚非营利性的全球卫生药物开发(MDGH)公司就安进在研PDE4抑制剂AMG 634达成许可协议。AMG 634拟用于治疗结核病(TB)和麻风结节性红斑(ENL),目前处于Ⅱ期临床开发阶段。根据协议,MDGH将全权负责AMG 634的进一步开发和商业化;而安进将继续支持即将开展的、针对ENL和TB的两个Ⅱ期临床试验,为这两个研究提供研究药物并资助ENL研究。
医药热点
1.北京重点人群家医签约率超90%。12月25日,北京市召开“十三五”基层卫生建设成效媒体沟通会。北京市卫健委一级巡视员、新闻发言人高小俊在会上透露,“十三五”期间,该市将重点人群签约服务覆盖率和签约服务满意度列入市委“七有”“五性”监测评价体系,截至2020年10月底,共组建5158个家庭医生团队,签约794.5万人,总签约率为37%,重点人群签约率保持在90%以上。
2.上海成立全国首个新冠科。全国首个新冠科26日在上海市公卫临床中心正式成立。上海市公卫临床中心是上海市成人新冠肺炎病例唯一定点收治医院,随着该中心新冠科的成立,实现了专病专收,形成了新冠确诊病例从随访门诊、应急病区、影像检查、检验检测全流程闭环管理。今后,新冠科将以上海公卫中心应急医护梯队人员为班底,依托上海市级专家组、市级优质重症医学团队,以及多学科救治团队,为新冠肺炎患者保驾护航。
3.第四批国家药品集采正式启动。12月25日,上海阳光医药采购网发布《关于开展第四批国家组织药品集中采购相关药品信息收集工作的通知》,自2020年12月25日起,联合采购办公室开展第四批国家组织药品集采相关信息申报工作。本次集采药品申报范围共涉及90个品规,包括埃索美拉唑(艾司奥美拉唑)口服常释剂型、氨磺必利口服常释剂型、恩格列净口服常释剂型、恩曲他滨替诺福韦口服常释剂型等等。
股市资讯
【恒瑞医药】子公司上海恒瑞SHR-1819和SHR-1916注射液获批临床,分别用于治疗哮喘与晚期恶性肿瘤。
【金城医药】全资子公司金城素智获得头孢羟氨苄胶囊一致性评价受理通知书。
【艾德生物】公司与广生堂签署合作协议。公司将自主研发的肺癌多基因联合检测产品(即PCR-11基因)用于广生堂MET抑制剂GST-HG161在中国的伴随诊断,并将推进该产品注册审批,同时为其临床研究提供样本检测服务。
审评动向
1. CDE最新受理情况(12月27日)
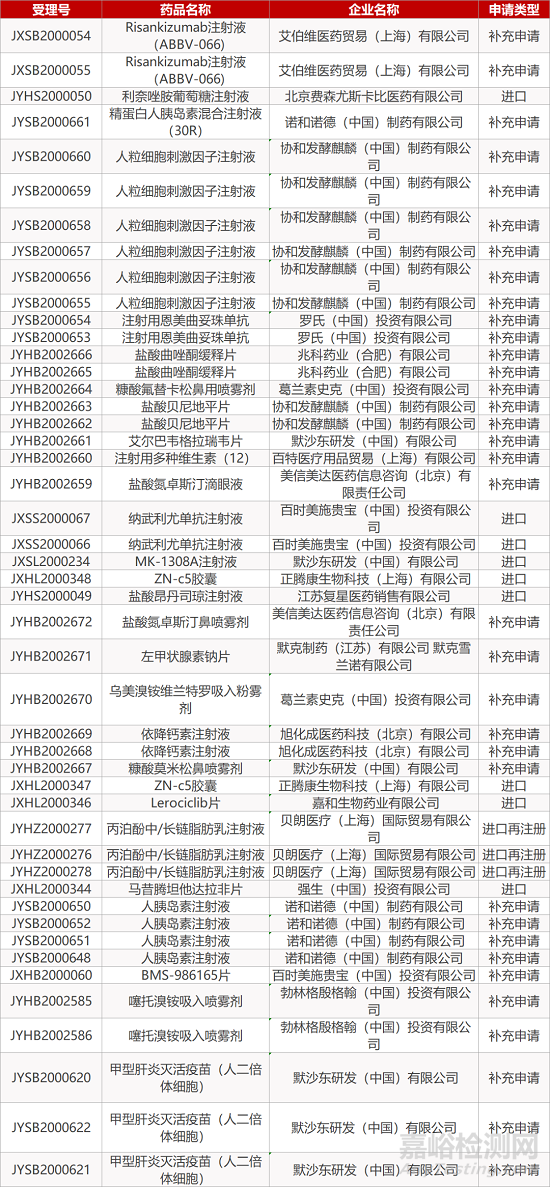
暂无
- The End -

来源:药研发


