您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-05 17:02
2020年国家局官网共发布了8期医疗器械飞检检查情况(35家企业)及6期停产整改通告(6家企业)。本文将41家企业被检查发现的缺陷项归类整理如下:
▍总体情况
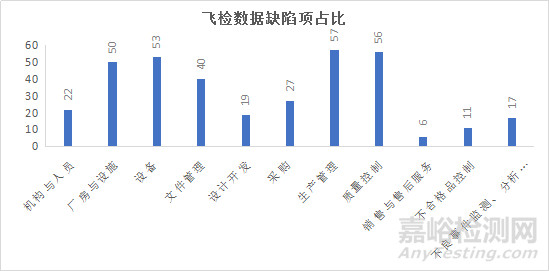
在41家企业数据中共有358条缺陷项,如下图可知,缺陷项主要集中在厂房设施、设备、生产管理及质量控制。
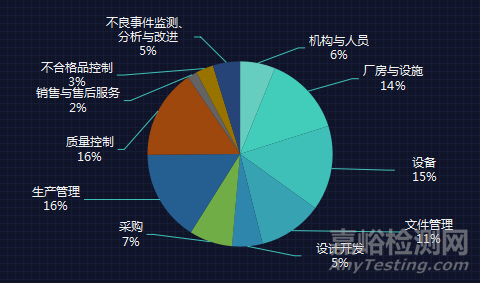
飞检数据中,设计开发缺陷项21条,占比5%。将其归类为验证与确认、规程与实施,发现的问题详情如下:
验证、确认与变更
1.产品设计更改结果记录(配液至灌装时限及灌装至灭菌时限更改),未按照《设计和开发控制程序》中产品设计开发更改控制要求对是否涉及产品的安全性、有效性和是否符合医疗器械产品注册的有关规定进行评审。未对设计更改后的验证进行评审。
2.企业未对产品椎板固定板系统特殊过程确认进行评审。
3.企业收集了中检院两个参考盘,第二代EGFR/ALK/MET基因突变检测国家参考品(360040-201901)和第二代KRAS/NRAS/BRAF/PI3KCA基因突变检测国家参考品(360041-201901)的说明书,无法提供评审记录,尚未进行国家参考品验证。
4.企业将首次注册中使用“白色复合无纺布”的规格变更,且物料供应商发生改变,但未对其进行识别、评审、验证与批准。
5.设计开发中未对作为与产品直接接触的保护型用具内包装瓶的力学及生物学进行评价;环氧乙烷残留检测用标准品为市售分析用“环氧乙烷水溶液”,因环氧乙烷在水溶液中极易降解,企业未对该标准品的适用性进行验证;环氧乙烷标准品曲线配制记录中有储备液的有效期记录,而《环氧乙烷残留检验作业指导书》并未对储备液进行效期规定,储备液和标准曲线的配制方法也未经有效性验证;用于无菌检测阳性对照的菌种的保存形式为瓷珠,每管12粒,存于三层气相检测室的冰箱内,操作时需要整管转移到二层阳性间,接种完剩余瓷珠再放回冰箱,未对转移次数对菌种的影响进行验证,《无菌检验指导书》也未对菌种的安全管理进行规定;无菌检查验证方案和报告未涉及菌悬液定量方法确认。
6.半导体激光治疗仪变更评价中有关电源指示灯变更部分内容不完整,缺少电源指示灯形状、材质等内容的变更评价。未对半导体激光治疗仪成品检验规范、检验报告的《设计更改评审报告》的评审内容进行确认。
7.产品开发使用的操作系统、开放式图形库均发生多次变更和升级。企业未针对现成软件更新、验证与确认活动进行记录。
8.企业未能提供壳聚糖止血海绵原产品标准变更为技术要求、说明书调整等变更的评审记录。
9.中间品存放验证记录规定该实验需要使用恒温恒湿箱,未见相关设备使用记录。
10.查阅某批号的成品稳定性评价记录,研发部无使用新型冠状病毒2019-nCoV核酸检测试剂盒企业参考品记录。
11.该企业于2017年6月28日取得延续注册的乙型肝炎病毒表面抗体检测试剂盒(酶联免疫法)的产品注册证书,延续注册过程中产品说明书、标签发生变更,但企业未对此情形识别为设计开发变更。
规程与实施
1.设计开发输入的医疗器械法规不全,如缺少《医疗器械不良事件监测与再评价管理办法》等。
2.设计转换过程中,关键工序激光切割机的《设备操作及维护指导书》中未明确设备操作前应确认的具体要求。初洗作业指导书未对实际存在的验证代替品(不合格品)进行特殊标识要求。
3.产品设计开发中,未规定防护口罩密合性、一次性使用医用口罩和外科口罩的细菌过滤效率要求。
4.《药物混合工艺作业指导书》规定,聚合物取出后,剩余聚合物包装好,并用封口机封口进行保存,放置在低温冰箱内(实际存放在-20℃冰柜中),但未在文件中规定可重复冻融开封使用次数、使用期限;《支架喷涂、称量工艺作业指导书》用适量无水乙醇漂洗管芯、将适量药液倒入一只洁净烧杯中,未明确具体工艺参数。
5.设计开发控制程序中未规定评审人员组成和职责。
6.最近一次(2017年12月28日)用于粉体内包装的“自动塑料薄膜连续封口机”再确认报告中,封装温度的试验和结论均为某温度值,未规定封装温度范围值,《骨水泥产品包装操作指导书》中规定封装温度与粉体批生产记录中封装温度一致,但确认结果与输出使用要求不一致。
7.设计开发控制程序规定设计开发任务书由总经理批准,企业设计开发任务书由管理者代表李某批准,与文件要求不一致。
8.企业缺陷管理记录显示共修复4项缺陷,未针对缺陷管理形成文件和分析报告。
9.查看企业某型号产品的《变更记录表》,表中记录变更内容包括标签变化、软件升级及说明书文字错误等,但未见对已交付产品影响的评估分析。
10.《氧浓度传感器校正软件要求式样书》(即需求输入文件)认可时间为2014年8月28日,《制氧机浓度传感器校正软件机能式样书》(即详细设计文件)认可时间为2014年6月30日,即需求输入文件的认可时间晚于详细设计文件的认可时间。

来源:Internet


