您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-21 10:47
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:18条资讯,阅读时长约:3分钟 」
今日头条
IL-36R单抗拟纳入突破性治疗品种。勃林格殷格翰IL-36R单抗BI 655130(spesolimab)注射液获CDE拟纳入突破性治疗品种。BI655130是一款“first-in-class”在研新药,全球范围内已进入Ⅲ期临床阶段。在中国,BI 655130已获批多项临床试验,涉及的适应症包括急性或慢性泛发性脓疱性银屑病、泛发性脓疱性银屑病等。本次,BI 655130被纳入拟突破性治疗品种的适应症为泛发性脓疱型银屑病。
国内药讯
1.复星「不限癌种」抗癌药获批临床。复星旗下重庆复创医药1类新药FCN-098胶囊获CDE批准临床。FCN-098是一款TRK抑制剂,拟用于治疗晚期恶性实体瘤。TRK融合癌可以出现在身体任何部位。出现NTRK基因融合的肿瘤类型包括乳腺癌、结直肠癌、肺癌、甲状腺癌等。全球范围内目前已有2款小分子TRK抑制剂获批上市,分别为拜耳/Loxo的拉罗替尼(Vitrakvi)和罗氏/Ignyta 的恩曲替尼(Rozlytrek)。
2.度普利尤单抗新适应症拟纳入优先审评。赛诺菲/再生元度普利尤单抗(Dupixent)第3项适应症上市申请获CDE拟纳入优先审评,用于治疗外用处方药控制不佳或不建议使用外用处方药的≥6岁至<12岁儿童和成人中重度特应性皮炎患者。Dupixent是一款IL-4/IL-13单抗,也是全球首个获FDA及欧盟EMA批准治疗中重度特应性皮炎的靶向生物制剂。在中国,度普利尤单抗是临床急需境外新药之一,已于2020年6月获批用于治疗成人中重度特应性皮炎。
3.信达新一代TKI上Ⅱ期临床。信达生物与葆元生物联合开发的下一代ROS1/NTRK抑制剂taletrectinib治疗NTRK融合实体瘤的Ⅱ期篮式试验(NCT04617054)完成首例患者给药。Taletrectinib是一款新一代的酪氨酸激酶抑制剂(TKI),已在ROS1融合非小细胞肺癌的Ⅱ期临床中显示出良好的药效和安全性,在克唑替尼初治患者中客观缓解率(ORR)达到93%(14/15),在克唑替尼经治患者中ORR达到60%。
4.步长四价流感病毒裂解疫苗启动Ⅰ/Ⅱ期临床。步长制药旗下产品“四价流感病毒裂解疫苗”获得云南省疾控中心疫苗临床试验伦理委员会伦理审查批件,启动Ⅰ/Ⅱ期临床试验。四价流感病毒裂解疫苗主要用于刺激机体产生抗流行性感冒病毒的免疫力,预防本毒株引起的流行性感冒。据统计,中国流感病毒裂解疫苗折算批签发额2018年和2019年分别为48,172 万元和96,720万元。
5.复星凯特CD19自体CAR-T疗法即将获批上市。复星凯特靶向CD19的自体CAR-T细胞疗法阿基仑赛注射液(axicabtagene ciloleucel)在中国的上市申请处于“在审批”阶段,有望即将获批上市,成为国内首个CAR-T疗法。阿基仑赛注射液由吉利德/Kite制药开发,在美国已获批上市(商品名:Yescarta),用于治疗接受过两线或以上系统性治疗的复发或难治性大B细胞淋巴瘤,以及复发或难治性滤泡性淋巴瘤(FL)患者。
6.国药新冠疫苗启动3-17岁免疫桥接试验。国药中生北京所研发的新冠灭活疫苗日前在阿联酋阿布扎比启动3-17岁小年龄组的免疫桥接临床试验。这项试验将监测900名儿童的免疫反应。据悉,阿拉伯联合酋长国阿布扎比王储穆罕默德·本·扎耶德·阿勒纳哈扬的儿子谢赫·泰布·本·穆罕默德陪同其子女、侄女和侄子参加了此次免疫桥接临床研究。
7.百济神州「泽布替尼胶囊」新适应症获批。NMPA附条件批准百济神州泽布替尼胶囊(百悦泽)新适应上市,用于治疗成人华氏巨球蛋白血症患者。这也是泽布替尼在中国取得第3项适应症批准,以及针对华氏巨球蛋白血症在全球的第2项批准。在一项单臂关键性II期临床中,中位随访时间为14.9个月,经IRC评估的主要缓解率(MRR)达到 72.1%(95% CI:56.3,84.7)。
国际药讯
1.礼来IL-17A抑制剂获英国NICE批准。英国国家健康与临床卓越研究所(NICE)日前发布指南,推荐礼来IL-17A单抗Taltz(ixekizumab)纳入英国医保体系NHS,用于治疗活动性中轴型脊柱关节炎(axSpA)。NICE仅推荐在TNF抑制剂不合适或不能很好地控制病情的情况下使用Taltz。在临床试验中,与安慰剂相比,Taltz治疗组在第16周时患者达到ASAS40应答的比例更高。
2.诺华放射性配体疗法获FDA突破性疗法认定。FDA授予诺华潜在“first-in-class”靶向放射性配体疗法(radioligand therapy, RLT)177Lu-PSMA-617突破性疗法认定,用于治疗PSMA阳性去势抵抗性前列腺癌。一项Ⅲ期临床VISION最新结果显示,与最佳标准治疗(SOC)相比,177Lu-PSMA-617治疗组患者中位总生存期延长了4个月,死亡风险降低38%(HR=0.62, 95% CI:0.52,0.74),放射学疾病进展或死亡的风险也降低60%(HR=0.40,99.2% CI:0.29,0.57),但该组与治疗相关不良事件的比例高于对照组(85.3%vs28.8%)。
3.LENZ拟加速开发治疗老花眼配方。LENZ Therapeutics宣布完成4700万美元的A轮融资,用于推进其正在开发的小分子乙酰胆碱受体激动剂aceclidine的眼药水配方。Aceclidine可引起瞳孔收缩,产生针孔效应,从而改善近视力(near vision),具有治疗老花眼的潜力。一项Ⅱ期临床结果显示,在30分钟内,Aceclidine使53%的患者在视力检测中表现出三行以上的阅读改善,81%的患者表现出两行以上的阅读改善。并且,这种显著改善效果持续长达7小时。
4.BMS与卫材合作开发FRα抗体偶联药物。卫材与百时美施贵宝 (BMS)就卫材的FRα抗体偶联药物(ADC) MORAb-202达成战略合作协议。两家公司将在日本、中国、亚太地区国家、美国、加拿大、欧洲(包括欧盟、英国、俄罗斯)地区共同开发和商业化MORAb-202;BMS将全权负责合作区域以外地区药物开发和商业化。根据协议,卫材将获得4.5亿美元前期付款,2亿美元研发费用,以及可能高达24.5亿美元的里程碑潜在付款。
5.吉利德联合Shoreline开发即用型NK细胞疗法。吉利德旗下Kite公司与Shoreline 公司达成战略合作,共同开发一系列治疗血液恶性肿瘤的创新同种异体(allogeneic)新型细胞疗法。根据协议,Shoreline将获得预付款,以及可能总额超过23亿美元的里程碑付款。合作最初将专注于开发由诱导多能干细胞生成的嵌合抗原受体(CAR)NK细胞疗法。Kite可以选择扩大合作范围,选定一个靶向未公开靶标的iPSC CAR巨噬细胞开发项目。
6.美国计划投入逾30亿美元开发口服抗病毒药。美国卫生及公共服务部(HHS)周四表示,拜登政府将投资逾30亿美元研发和生产抗病毒药物,以治疗COVID-19以及其他可能发展为大流行病的危险病毒。新投资包括:超过3亿美元用于支持研究和实验室,近10亿美元用于临床前和临床评估,以及近7亿美元用于研发和制造,以及至多12亿美元用于开发和发现新药。
医药热点
1.医联学术委员会成立。互联网医院医联宣布成立学术委员会,中国工程院院士、著名肿瘤病因学专家程书钧,世界高血压联盟前任主席、著名心血管内科专家刘力生任首席顾问专家,学术委员会首批专家还包括数十位在各疾病领域钻研多年的学科带头人及专家教授。医联旨在与学术委员会专家一起,深入交流和探讨互联网医疗发展,整合线上线下医疗资源,以发挥“互联网+医疗健康”在疾病预防、诊断、治疗、康复中的支撑作用。
2.今年医改重点工作任务发布。国务院办公厅日前发布《深化医药卫生体制改革2021年重点工作任务》,明确工作任务包括4部分,细分为20项工作。《任务》要求,深入实施健康中国战略,推广福建省三明市医改经验,强化改革系统联动,促进优质医疗资源均衡布局,统筹疫情防控与公共卫生体系建设,继续着力推动把以治病为中心转变为以人民健康为中心,着力解决看病难、看病贵问题。
3.中国无偿献血位居全球前列。国家卫健委日前在例行发布会上宣布,全国无偿献血人次从1998年的32.8万提高到2020年的1553万,增长了47倍;每千人口的献血率从1998年的4.8‰,提升到了2020年的11.1‰;“十三五”期间,全国采血量、采血人次比“十二五”时期分别增长了17%和17.9%。世界卫生组织发布的全球血液安全报告显示,中国在无偿献血、血液安全和临床用血等方面位居全球前列。
4.新冠野生型抗体针对变异株或无效。印度研究者日前上传一份最新的新冠病毒抗体阳性抽样预印本。在3月15日-6月10日印度新冠突变株疫情最严重期间,德里地区共采样了4509人,检查数据显示德里地区抗体阳性率74%。通过对比相同采样地区去年的数据,这份预印本提示——印度可能又一次完成了通过自然感染达到的“群体免疫”。据悉,德里地区今年2月时新冠感染血清抗体阳性水平已达到56.13%。
审评动向
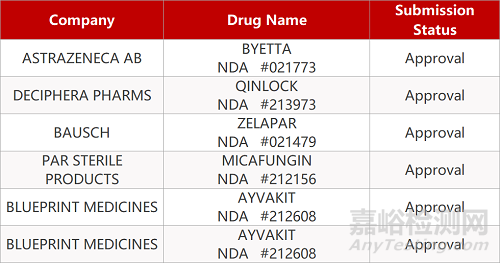
2. FDA新药获批情况(北美06月17日)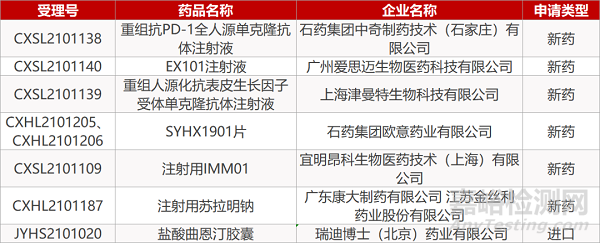

来源:药研发


