您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-08-22 21:26
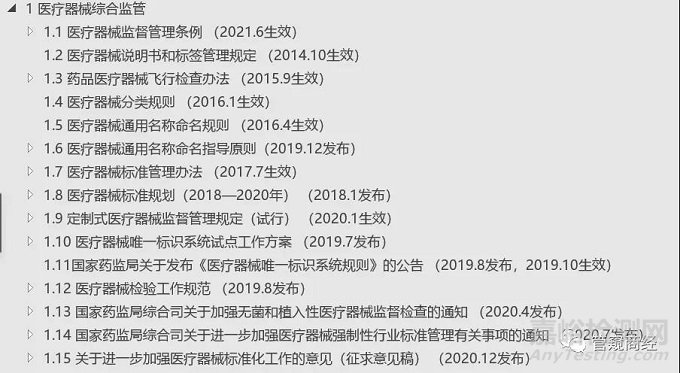
1医疗器械综合监管
1.1 医疗器械监督管理条例(2021.6生效)
1.2 医疗器械说明书和标签管理规定(2014.10生效)
1.3 药品医疗器械飞行检查办法(2015.9生效)
1.4 医疗器械分类规则(2016.1生效)
1.5 医疗器械通用名称命名规则(2016.4生效)
1.6 医疗器械通用名称命名指导原则(2019.12发布)
1.7 医疗器械标准管理办法(2017.7生效)
1.8 医疗器械标准规划(2018—2020年)(2018.1发布)
1.9 定制式医疗器械监督管理规定(试行)(2020.1生效)
1.10 医疗器械唯一标识系统试点工作方案(2019.7发布)
1.11国家药监局关于发布《医疗器械唯一标识系统规则》的公告(2019.8发布,2019.10生效)
1.12 医疗器械检验工作规范(2019.8发布)
1.13 国家药监局综合司关于加强无菌和植入性医疗器械监督检查的通知(2020.4发布)
1.14 国家药监局综合司关于进一步加强医疗器械强制性行业标准管理有关事项的通知(2020.7发布)
1.15 关于进一步加强医疗器械标准化工作的意见(征求意见稿)(2020.12发布)
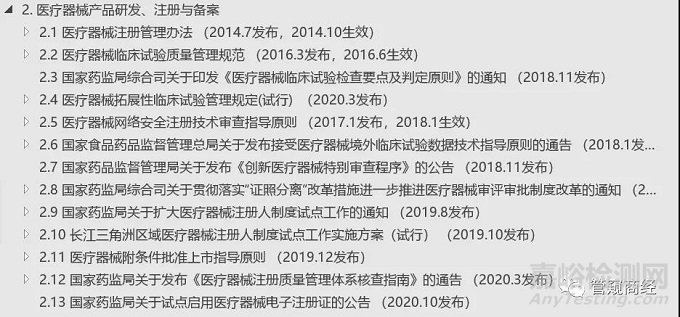
2医疗器械产品研发、注册与备案
2.1 医疗器械注册管理办法(2014.7发布,2014.10生效)
2.2 医疗器械临床试验质量管理规范(2016.3发布,2016.6生效)
2.3 国家药监局综合司关于印发《医疗器械临床试验检查要点及判定原则》的通知(2018.11发布)
2.4 医疗器械拓展性临床试验管理规定(试行) (2020.3发布)
2.5 医疗器械网络安全注册技术审查指导原则(2017.1发布,2018.1生效)
2.6 国家食品药品监督管理总局关于发布接受医疗器械境外临床试验数据技术指导原则的通告(2018.1发布)
2.7 国家药品监督管理局关于发布《创新医疗器械特别审查程序》的公告(2018.11发布)
2.8 国家药监局综合司关于贯彻落实“证照分离”改革措施进一步推进医疗器械审评审批制度改革的通知(2018.11发布)
2.9 国家药监局关于扩大医疗器械注册人制度试点工作的通知(2019.8发布)
2.10 长江三角洲区域医疗器械注册人制度试点工作实施方案(试行)(2019.10发布)
2.11 医疗器械附条件批准上市指导原则(2019.12发布)
2.12 国家药监局关于发布《医疗器械注册质量管理体系核查指南》的通告(2020.3发布)
2.13 国家药监局关于试点启用医疗器械电子注册证的公告(2020.10发布)
3医疗器械生产
3.1 国家药品监督管理局关于《医疗器械生产监督管理办法(修订草案征求意见稿)》公开征求意见的通知(2021.3发布)
3.2 医疗器械生产监督管理办法(2017.11生效)
3.3 国家食品药品监督管理总局关于印发《医疗器械生产质量管理规范现场检查指导原则》等4个指导原则的通知(2015.9发布)
3.4 国家食品药品监督管理总局《医疗器械生产企业质量控制与成品放行指南》(2016.12发布)
3.5 国家药品监督管理局《医疗器械生产企业管理者代表管理指南》(2018.9发布)
3.6 国家药监局关于发布医疗器械生产质量管理规范附录独立软件的通告(2019.7发布,2020.7生效)
3.7 国家药监局综合司关于印发《医疗器械生产质量管理规范独立软件现场检查指导原则》的通知(2020.5发布)
3.8 国家药监局关于进口医疗器械产品在中国境内企业生产有关事项的公告(2020.9发布)
3.9 国家食品药品监督管理总局关于发布《禁止委托生产医疗器械目录》的通告(2014.9发布)
4医疗器械经营
4.1一般经营
4.1.1 国家药品监督管理局关于《医疗器械经营监督管理办法(修订草案征求意见稿)》公开征求意见的通知(2021.3发布)
4.1.2 医疗器械经营监督管理办法(2017.11发布)
4.1.3 国家食品药品监督管理总局关于印发《医疗器械经营企业分类分级监督管理规定》的通知(2015.8发布)
4.1.4 国家食品药品监督管理总局办公厅关于个体工商户从事医疗器械经营活动有关问题的复函(2015.9发布)
4.1.5 国家食品药品监督管理总局关于印发《医疗器械经营质量管理规范现场检查指导原则》的通知(2015.10发布)
4.1.6 国家药监局关于公布《免于经营备案的第二类医疗器械产品目录》的公告(2021.6发布)
4.2医疗器械进出口
4.2.1 国家食品药品监督管理总局关于发布医疗器械产品出口销售证明管理规定的通告(2015.9发布)
4.2.2 关于发布《药品医疗器械境外检查管理规定》的公告(2018.12发布)
4.2.3 关于对进口捐赠医疗器械加强监督管理的公告(2006.2发布)
4.3医疗器械网络销售
4.3.1 医疗器械网络销售监督管理办法(2017.12发布,2018.3生效)
4.3.2 国家食品药品监督管理总局办公厅关于实施《医疗器械网络销售监督管理办法》有关事项的通知(2018.2发布)
4.4医疗器械召回
4.4.1 医疗器械召回管理办法(2017.1发布,2017.5生效)
4.4.2 国家食品药品监督管理总局关于实施《医疗器械召回管理办法》有关事项的通知(2017.4发布)
5医疗器械使用管理
5.1 医疗器械使用质量监督管理办法(2015.10发布,2016.2生效)
5.2 医疗器械不良事件监测和再评价管理办法(2018.8发布,2019.1生效)
5.3 医疗器械临床使用管理办法(2021.1发布,2021.3生效)
5.4 国家药监局关于发布医疗器械注册人开展不良事件监测工作指南的通告(2020.4发布)
5.5 国家药监局关于发布《医疗器械注册人开展产品不良事件风险评价指导原则》的通告(2020.11发布)
5.6 国家药监局综合司关于印发《医疗器械注册人备案人开展不良事件监测工作检查要点》的通知(2021.4发布)
6医疗器械广告
6.1 药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法(2019.12发布,2020.3生效)




来源:管窥商经


