您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-10-30 16:14
在标准GB/T 16886.11-2011的评估项目表中,包括急毒、亚急毒、亚慢毒和慢毒测试,其实这些测试都可以纳入全身毒性测试的范围,本标准涉及一般全身毒性评价。所以,小编今天将带领大家弄清楚该标准要求,并了解如何开展全身毒性测试。
全身毒性是医疗器械在使用过程中,由于产品或其材料的可沥滤物产生的潜在不良作用。因为,这些可沥滤物有可能通过吸收、分布及代谢,对与产品没有直接接触的组织或器官产生一般全身毒性作用。由于医疗器械及其材料和应用范围种类繁多,使用的材料特性以及预期用途也会有很大差异, GB/T 16886.11-2011只是针对产品材料及其临床应用,提出在全身毒性测试中要满足的要求,在设计全身毒性试验时要考虑到具体的方法学,适当的研究设计必须与器械材料的特性及其预期临床应用相适应。

02、GB/T 16886.11-2011全身毒性试验重要术语和定义
⏩剂量效应:个体或群体研究对象中,剂量与特定生物学反应程度之间的关系;
⏩急性全身毒性:在24h内一次、多次或连续接触试验样品后在任何时间内发生的不良反应;
⏩亚急性全身毒性:在24小时至28天内,多次或连续接触试验样品后发生的不良反应。其中,亚急性静脉内研究通常定义持续治疗时间为24小时至14天;
⏩慢性全身毒性:在重复或连续接触试验样品后,测试个体在绝大部分寿命期内发生的不良作用。慢性全身毒性研究通常持续6至12个月;
⏩亚慢性全身毒性:在重复或连续接触试验样品后,测试个体在部分寿命期内发生的不良作用。亚慢性毒性研究在啮齿类动物中,持续时间通常为90d,其他物种,则不超过其寿命期的10%。亚慢静脉注射研究一般规定接触时间为14d-28d。
03、全身毒性测试的基本考虑
总原则
⏩测试的总原则是要基于器械接触方式和接触周期,选择适宜试验;
⏩应在在最终产品,或是来源于最终产品的有代表性组成成分上进行试验,反映生产及相关处理过程产生的影响;
⏩当考虑动物试验时,要符合ISO 10993-2中规定的关于动物福利的要求。
动物种属选择、状况和饲养
⏩对于医疗器械的急性经口、静脉、皮肤和吸入研究,首选小鼠或大鼠,皮肤和植入研究可选择家兔。当进行一系列不同持续时间的全身毒性研究时,首选采用同一种动物种属和动物品系,以排除不同物种间的差异产生的影响;
⏩测试应使用已知来源、且具有确定的微生物状况及健康繁殖的年轻成年动物。在研究开始时,同性别动物的体重变化不应超过平均体重的±20%。如果使用雌性动物时,应确认其为未经产且未怀孕状态;
⏩饲养管理是另外一个不可忽视的重要因素。试验前和试验周期内动物应适应实验环境,控制好环境条件(如垫料、温度、湿度),并使用适当的动物饲养护理技术(如调整饲料成分),才能获得有效的测试结果。
剂量组大小和数目
⏩每剂量组动物数量取决于研究目的,应根据试验周期增加动物样本数量,以获得足够的数据用于生物学评估。
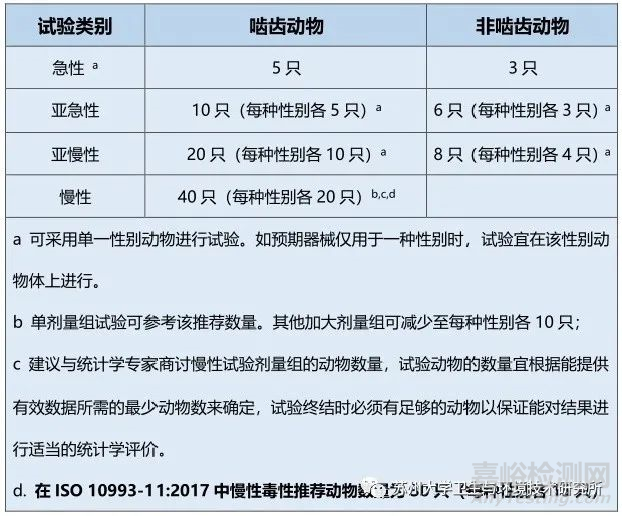
⏩考虑动物福利,建议使用的最小样本数量,具体见下表,给出了推荐接触途径的最少动物数量。
推荐的剂量组最少动物数量
暴露途径、剂量及频率
⏩医疗器械或其可沥滤物与人体的接触途径有很多,在选择暴露途径时,要尽可能与临床使用保持一致。常用的暴露途径包括:皮肤接触、植入、吸入、肌肉注射、腹腔注射、静脉注射、口服以及粘膜接触等;
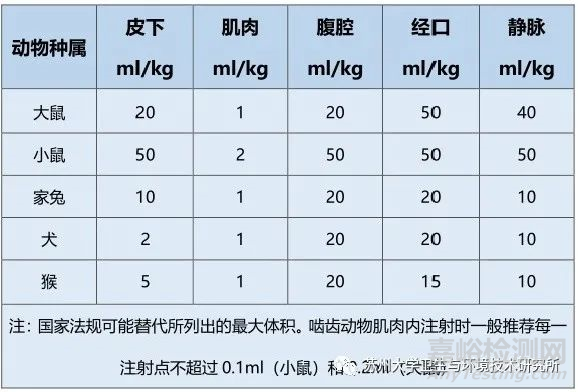
⏩在选择暴露剂量时,应全面考虑体重/表面积、给药速度、给药次数和频率、样品理化和生物学性质等因素的影响。该标准在附录B列举了不同途径单次给样剂量的最大值,具体推荐值见下表;
⏩暴露频率应基于样品临床相关性。例如,在急性全身毒性测试中,动物应在24小时内接受单次或多次给样;而在重复暴露测试中,动物要每天给样,每周七天持续测试。如果选用其他方案,若评估后是合理的,也同样可以接受。
试验样品接触最大剂量体积
临床观察
⏩根据毒性反应性质、严重程度、毒性反应速度和恢复期来确定临床观察频率和间隔时间;
⏩在研究的早期阶段,特别是急性毒性,需要增加观察频率。对于一般的临床观察而言,每天至少一次全面观察动物存活情况和临床反应。
⏩应系统记录观察到的现象,并保留每只动物的观察记录;
病理学
⏩临床病理学研究,通常会从血液学、临床生化分析和尿液分析参数进行分析评估;
⏩大体病理学:对动物的尸体进行详细检查和脏器称重;
⏩组织病理学:将动物器官和组织,置于适当的固定液中进行完整组织病理学检查。
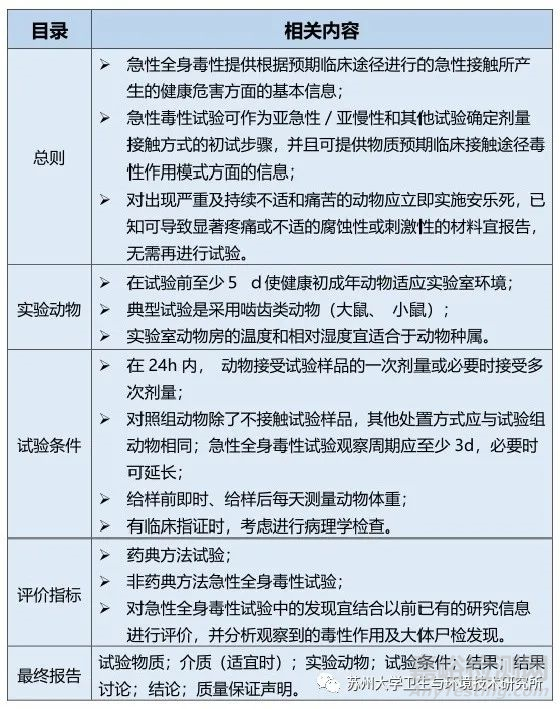
急性全身毒性试验
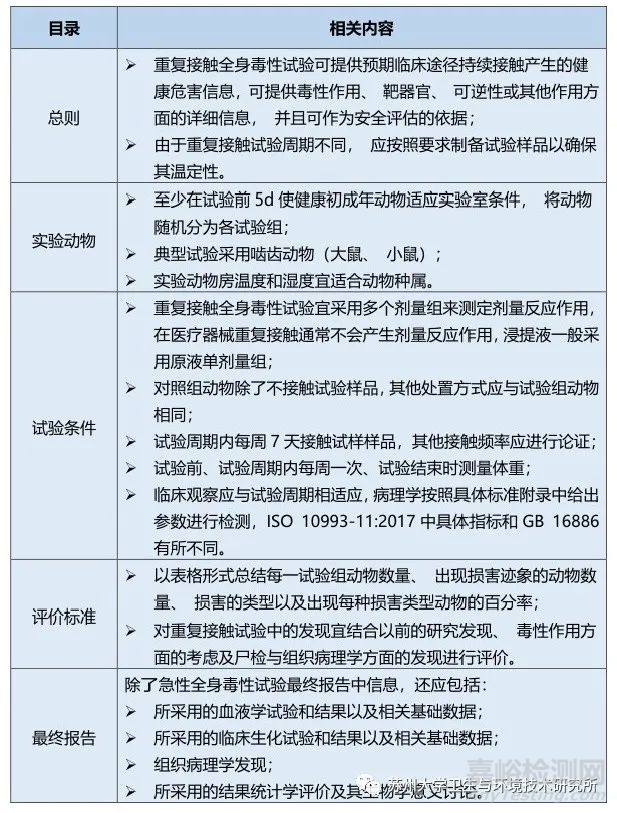
重复接触全身毒性试验(亚急性、亚慢性和慢性全身毒性)

来源:Internet


