您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-02-18 21:38
上市后临床跟踪PMCF
目的:明确器械预期的生命周期内的临床性能,被定义的风险是否可以接受以及在实证的基础上发现新出现的临床风险。
Question:为什么需要进行上市后临床跟踪?
►罕见并发症及其他不良反应只有在器械的广泛使用或长期使用后才暴露出来;
►器械在整个生命周期中是否安全和有效?
►剩余风险的可接受性是否可以接受,是否会出现新的风险?
器械上市后临床跟踪PMCF的方法
1)将上市前临床试验的随访时间延长
2)启动新的临床调查
什么情况下可以豁免上市后临床随访试验?
1)当器械中,长期的临床有效期和安全性已经从器械以往的使用过程中得到验证;
2)当其他售后监督信息能够提供关于临床风险方面的数据。
MDCG 2020-7 Guidance on PMCF Plan Template
MDCG 2020-8 Guidance on PMCF Evaluation Report Template
上市后临床跟踪试验在下面情况下是强制的
1)创新的器械;
2)器械的设计适用症及预期用途等发生重大的变化;
3)产品使用的风险高;
4)针对高风险的解剖部位/高风险的人群;
5)出现了有关安全性和有效性方面新的信息;
6)当上市前临床评估时走的是等同性路径(特别是高风险产品!!)
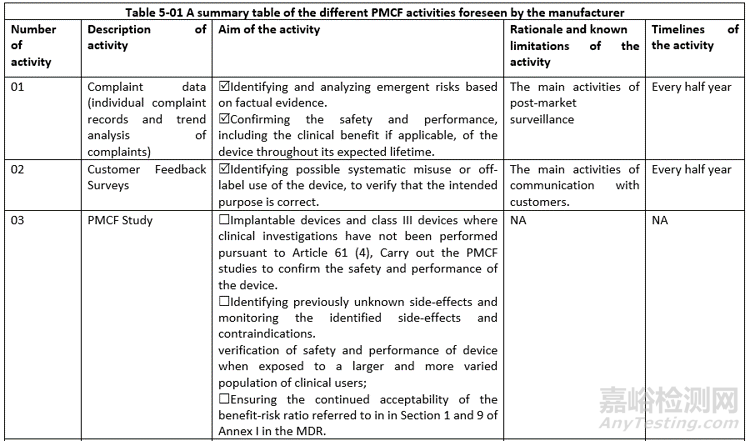
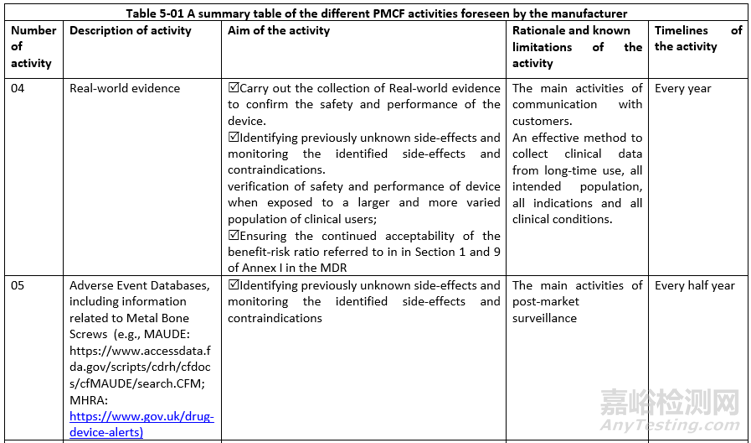
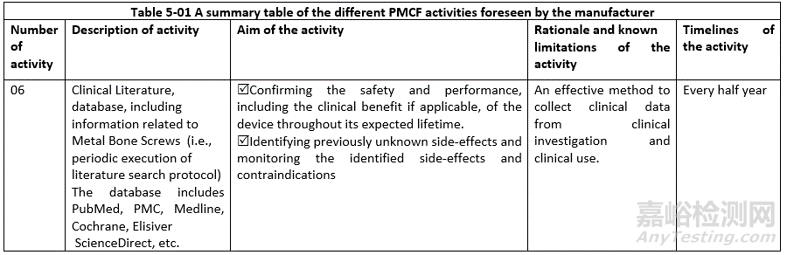
PMCF活动:投诉、客户反馈、PMCF研究、真实世界数据、不良事件、文献数据
真实世界数据(RWD)
是指来源于日常所收集的各种与患者健康状况和/或诊疗及保健有关的数据。
患者随访调查
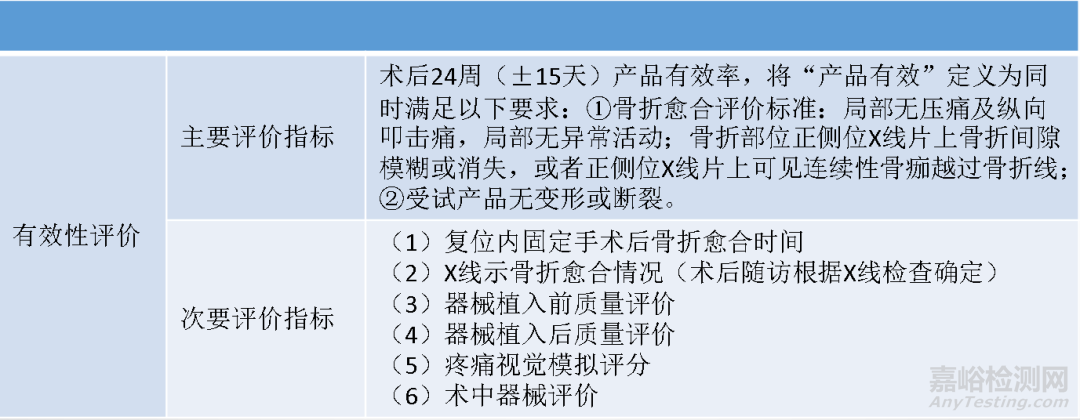



对于Ⅲ类器械和植入器械(非定制或研究器械),制造商应起草一份安全和临床性能总结,该临床和性能总结应是拟定使用者及患者明白,并应由公告机构验证后通过Eudamed向公众开放。
SSCP信息必须来源于CE技术文件,并且一致。SSCP应该保持更新,如果PMCF和PSUR每年更新,则SSCP也应更新,并且CE技术文件中相关内容也应同步更新。
SSCP应客观并充分总结有利和不利数据。
制造商应在说明书或标签上列出SSCP的获得地址。
SSCP应翻译成目标销售国的语言。
可读性:医生和患者都能看懂。SSCP应该以有组织且明确的方式呈现。
SSCP的验证和上传
对于Ⅲ类和Ⅱb植入器械(缝合线,吻合钉等除外)应该每个器械都评审和上传。
对于Ⅱa和Ⅱb植入器械(缝合线,吻合钉等)应按照抽样规则评审SSCP,并将所有SSCP上传。如果发证评审时没审核的SSCP,需要在证书有效期内的年审中评审,每年至少一个。
换证时的SSCP验证与首次认证时要求一致。
SSCP由公告机构NB上传。
SSCP更新频率和PSUR相同。
SSCP的内容(不限于)
1)器械和制造商标识,包括基本UDI-DI和SRN(如已发布),器械分类,器械命名方式,欧盟代表的名字和SRN,NB信息,首次CE认证时间;
2)器械的预期用途,适用症,禁忌症和目标人群;
3)器械描述,包括前一代或者变体的参考文件,和差别说明,以及附件、其他器械和其他产品等与该器械联合使用的说明;
4)有关任何剩余风险和不良影响、警戒和预防措施的信息;
5)附录XIV中参考的临床评价总结和上市后临床跟踪的相关信息;
6)可能的诊断或治疗替代品;
7)为使用者提供的建议概况和培训;
8)参考的协调标准和CS;
9)更新历史:版本号和发行时间
Reference:MDR, Article 32
MDCG 2019-9 Summary of safety and clinical performance-A guide for manufacturers and notified bodies

来源:微珂器械服务


