您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-23 14:47
如何提高难溶性药物的溶解度一直都是当今药剂学领域研究的热点之一,现处于研发阶段的药物大约有70%处于BCS Ⅱ类(低溶解、高渗透)药物,还有20%处于BCS Ⅳ类(低溶解、低渗透),所以研发人员的任务一直都在致力解决提高药物的溶解度,去满足临床的口服生物利用度。然而难溶性药物的制剂研究仍旧面临很大的严峻挑战:这些BCS Ⅱ/Ⅳ类药物存在低溶解度、溶解速率即低口服生物利用度、食物效应易造成吸收差异明显、在前期研发阶段设计高剂量的毒性爬坡实验比较困难、且非口服给药途径制剂设计更加困难。
固体分散体技术的开发应用可以提高难溶性药物的溶解度和生物利用度,且现阶段已经将固体分散体作为中间体用来开发制备速释、缓释、肠溶制剂,使固体分散体的研究进入新的阶段。
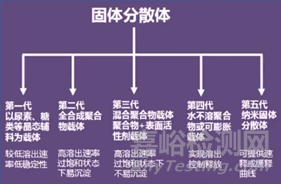
目前已经上市的固体分散体技术产品包括诺华公司的抗真菌药灰黄霉素、以及西安杨森公司的抗真菌药伊曲康唑等等,真正上市的SD品种并不多,阻碍其广泛商业化的因素有:扩大生产问题以及贮存期的稳定性等,而SD的不稳定性会显著影响药物的溶解性、稳定性以及相应的制剂制备工艺等。例如用于治疗帕金森症的罗替戈汀贴剂,贴剂表面在存储过程中表面会出现雪花状结晶,结晶现象严重影响了该贴剂的药物递送速率,影响药效的发挥,该产品在2008年被迫从美国市场撤回,直到2012年才重新获批。
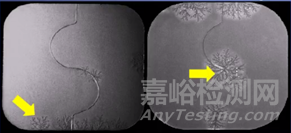
造成固体分散体不稳定的因素有很多,比如载体选择不当、药物与高分子载体的比例选择不当载药浓度过高、储存温度过高、湿度过大或者存储时间过长等均会使SD的溶出变低,我们也称之该现象为老化现象。如果从本质上去分析不稳定原因,那主要涉及机制包括热力学和动力学方面的因素,想要从根本解决该问题,需要从这些方面出发,对SD的性质进行改进。
1. 药物/聚合物载体比例不当
当药物和高分子聚合物载体比例选择不当时,会影响SD的储存稳定性。从热力学因素来分析:SD的物理稳定性取决于混合前后系统自由能的变化,如果混合后系统的自由能增加,即固体分散体的自由能大于混合前组分的自由能之和,则系统将朝混合前的状态变化,药物就会析出晶体。而药物-聚合物相互作用参数决定了自由能变化的方向,因此SD的热力学稳定性主要取决于药物-聚合物分子间力的强度,药物负载越多,分子间作用力越弱,意味着自由能越高,结晶越容易,体系就越不稳定。因此在制备SD时,需要对药物/高分子聚合物载体的比例进行筛选。例如以下研究中对利托纳韦/共聚维酮固体分散体在不同载药量时药物和高分子溶出行为的对比,研究发现高载药量50%时药物和载体的溶出都很低,而载药量10%时药物和载体均可以维持一个较高的溶出水平。究其原因,可能是在低载药量的时候药物和高分子都可以很方便的溶出,因为高分子的水溶性好,药物可以很快的溶出;而在高载药量的时候,水溶性良好的高分子载体凝聚太快,所以造成界面存留了大量的药物,由于势能变化导致药物发生结晶从而造成溶出减缓。

2. 药物与高分子聚合物载体之间的相互作用
药物与高分子载体之间可以通过氢键、范德华力、离子间相互作用等各种弱相互作用力来限制药物分子在聚合物基体中的自由移动,使得系统具有高稳定性。因此如何选择载体也是SD研究中最基础也是最重要的一个环节。药物与载体间的相互作用力主要是氢键或者离子键作用,通常而言含质子给予体的药物与含质子接受体的高分子载体之间会形成牢固的氢键或离子键,载体和药物之间的作用力越强,那么药物的晶型形态也就越稳定。例如有研究显示低浓度1%的PVP高分子载体通过氢键作用可以抑制无定形硝苯地平的重结晶,使其存放20天仍保持无定形状态。
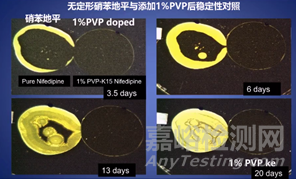
3. 高分子聚合物载体的合理选择
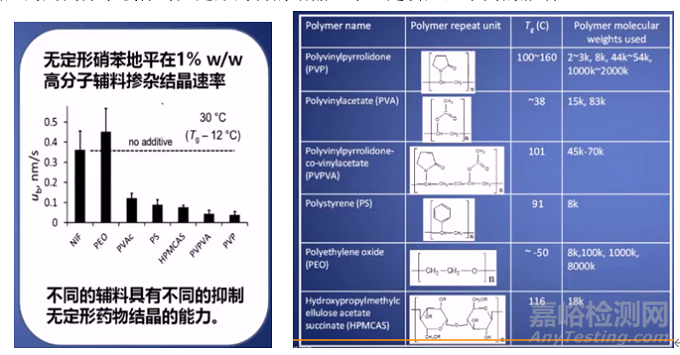
我们知道选用不同的高分子材料作为载体,对制剂达到溶出和重结晶能力有着不同的的影响,选用不同载体除了可以提高药物与载体间的相互作用力之外,选用合适的载体还可以提高体系的玻璃转化温度。玻璃转化温度(Tg)是衡量药物从无定形转化为晶体形态快慢的一个重要指标。在Tg以下,无定形处于玻璃态的冻结状态,分子运动受限,只是构成分子的原子或基团在其平衡位置作振动;而在Tg以上,无定形处于一种粘弹态,分子运动加剧,分子运动的速率和范围越大,则SD重结晶的趋势就越大。SD的稳定性随着Tg的增加而增加,如果SD的Tg值远大于贮存的环境温度时,那么SD结晶老化的时间也就会延长,在适当的贮存环境和时间内可以保持相对稳定状态。因此,将低Tg的药物与高Tg的聚合物载体经过适当的方法制备,所得到的SD会具有更高的Tg。例如以下报道研究证实值较高的PVP、PVPVA或HPMCAS具有很好的抑制晶体能力,而有些辅料例如PEO 和NIF不但不能够抑制无定形药物的结晶,反而会促进晶体的生长,所以在选择载体的时候要进行合理的判断,不同类型药用高分子载体对无定形药物的结晶速率还是会产生不同的影响。
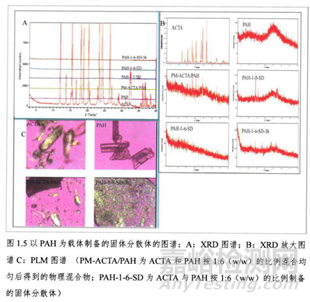
另外不同的亲水性载体材料具有不同的引湿性,会影响SD在贮存过程中水分吸收情况。如果载体的吸湿性过强,不仅仅会降低载体的黏性从而导致分子的迁移运动速率加快,最终导致无定形药物的重结晶趋势增大;同时它也会使体系的Tg值降低,降低其抗塑性,加快老化,使得药物的性质发生变化,溶出度降低,最终影响药效。例如PAH载体本身是无定形态物质,在ACTA:PAH=1:6时药物可完全在转化为无定形态,但是在制备3h后发现ACTA药物开始析出结晶,原因是PAH中的胺基是一种带正点的基团,本身与ACTA药物形成氢键的能力较弱,再加上它的吸湿能力较强,吸收的水分会加速重结晶过程,导致其对ACTA药物的抑晶能力较差。
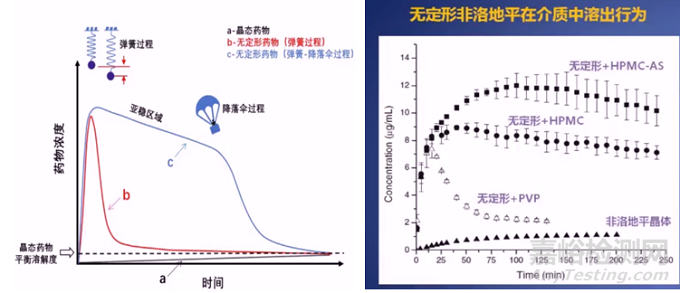
当然,选用不同的载体材料也会影响药物的溶出速率。理想状态SD的溶出释放行为应该是一个弹簧-降落伞过程,而非快速形成过饱和状态后快速析出,即俗称的弹簧过程。例如研究显示加入PVP,药物在该介质中可以达到很高的过饱和度,但很快就会出现析晶,但如果是一些纤维素类辅料,如HPMC 或HPMC-AS,他们可以使药物达到一个更高的过饱和度,而且维持相当长一段时间。这也提示我们不同的高分子载体具有不同抑制结晶的能力,基于药物性质选择合适的载体至关重要。
4. 制备方法
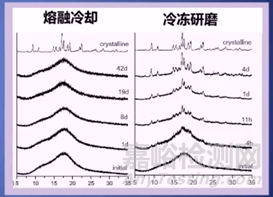
目前制备SD的方法有很多,常用的包括:热熔挤出、喷雾干燥、冷冻干燥、反溶剂沉淀法等,那不同的制备方法制备出来的SD其溶出速率、稳定性、形貌、粒径等也大不相同。例如通过冷冻研磨的辛伐他汀无定形在1天内迅速结晶,而熔融冷却方法制备的无定形42天均保持稳定。因此,我们要结合药物自身的耐高温性、溶解度、熔点等理化性质和用途,去选择合适的制备方法。
其实,我们如果把SD作为一种中间体,去开发片剂形式,这一整个工艺过程中影响SD稳定性的因素还有很多,不仅仅局限于以上因素,就比如将SD与其他辅料一起混合制粒、压片包衣过程中,药物自身结晶趋势、辅料本身含有的水分,以及环境湿度、湿法制粒中润湿剂水分的影响、压片过程中机械力和热量、包衣温度和包衣溶剂等等,都有可能诱导SD的重结晶。所以开发上市一款以固体分散体为基础的市场化产品还是比较难的,但我相信随着科学技术的发展以及科研工作者的不懈努力,固体分散体技术一定会越发成熟,会有更多高品质的固体分散体制剂成功上市。
参考文献:
[1] 蔡挺,无定形药物和固体分散体物理稳定性研究,中国药科大学药学院
[2] 张守德等,固体分散体稳定性的影响因素及改善方法的研究进展[J].中国医药工业杂志,2018,49(4):433-437
[3] 欧丽泉等,聚合物载体对固体分散体稳定性影响的研究进展[J].2020,40(19)
[4] 孟庆华,不同高分子聚合物对无定形态固体分散体稳定性的影响

来源:药事纵横


