您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-03-09 02:04
众所周知,6月1日,第二批实施医疗器械唯一标识工作就要正式开始实施了。距今只有不到3个月的时间,还没有着手的有关器械企业,相信也马上要开始紧锣密鼓的准备工作了。
政策法规和标准规范的学习是企业实施UDI先期准备过程中的一项重要工作。但国内UDI的实施究竟要遵循哪些标准规范呢?相信还有不少小伙伴都是一知半解。
今天就让小编带你去细数一下医疗器械UDI的那些现行标准!
1、《医疗器械唯一标识系统规则》
首先,器械人必须要学习吃透的一份重要文件就是它啦:《医疗器械唯一标识系统规则》。
此《规则》根据《医疗器械监督管理条例》制定,共计十八条。包含了医疗器械唯一标识系统的组成与定义、医疗器械唯一标识实施原则与意义、医疗器械唯一标识实施对象与要求、医疗器械唯一标识实施载体要求和医疗器械唯一标识数据库要求等内容。
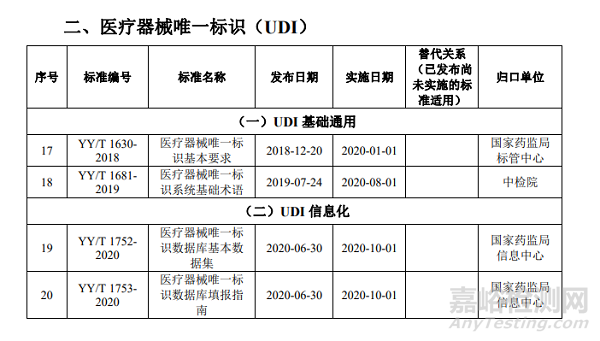
此外,根据不久前国家药监局医疗器械标准管理中心发布的《医疗器械标准目录汇编(2022版)》,在这部收录了现行1851项医疗器械国家和行业标准按技术领域的标准目录中,关于医疗器械唯一标识的标准共有4项。其中包括2项UDI基础通用和2项UDI信息化,分别是:
《YY/T1630-2018 医疗器械唯一标识基本要求》
《YY/T1681-2019医疗器械唯一标识系统基础术语》
《YY/T1752-2020医疗器械唯一标识数据库基本数据集》
《YY/T1753-2020医疗器械唯一标识数据库填报指南》
这4项标准内容全部围绕医疗器械唯一标识(UDI)展开,对企业实施UDI有重要的指导意义。它们的主要内容如下:
2、《YY/T1630-2018 医疗器械唯一标识基本要求》
该标准规定了医疗器械唯一标识的相关术语和定义、基本原则、产品标识的要求和生产标识的要求,适用于医疗器械唯一标识的管理。
包含4大常用术语和2项标识要求以及医疗器械唯一标识结构示意图和产品标识与医疗器械的包装示意图。
3、《YY/T1681-2019医疗器械唯一标识系统基础术语》
该标准界定了医疗器械唯一标识系统的基础术语和定义。包括6项通用术语定义、5项医疗器械唯一标识术语定义、5项医疗器械唯一标识数据载体术语定义和2项医疗器械唯一标识数据库术语定义。
4、《YY/T1752-2020医疗器械唯一标识数据库基本数据集》
该标准规定了医疗器械唯一标识数据库所涉及的基本数据集的类别、数据子集等相关内容,适用于医疗器械唯一标识数据库的建设。
医疗器械唯一标识数据库基本数据集主要包括医疗器械唯一标识数据库基本信息、医疗器械注册备案人/联系信息、医疗器械唯一标识发码机构信息数据子集。
规定了数据项处理原则、数据类型、标识格式、允许值、约束等要求。
5、《YY/T1753-2020医疗器械唯一标识数据库填报指南》
该标准规定了医疗器械唯一标识数据库填报产品标识及其相关信息的基本要求,适用于医疗器械唯一标识数据库的填报。主要包括数据接口交换不同格式要求详解示例和数据填报内容的要求。

来源:医械小灵通


