您当前的位置:检测资讯 > 热点事件
嘉峪检测网 2022-03-13 22:09
据FDA 3月11日更新的消息显示,FDA在3月1日发布安全通告勿使用艾康生物(杭州)ACON Biotech(Hangzhou)Co.,Ltd.的一款新冠自测试剂。
被通告产品:Flowflex SARS-CoV-2 Antigen Rapid Test(Self-Testing) (参考翻译:Flowflex SARS-CoV-2 抗原快速测试(自测试))
被通告原因:该产品未获得FDA的在美国销售使用的授权或者认证

产品包装正面和背面标签图如下:
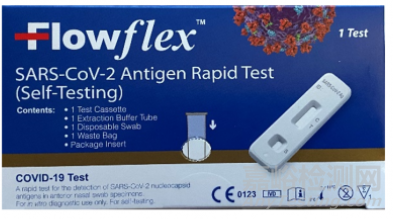

测试描述:
艾康的该产品使用鼻拭子样本来检测由SARS COV-2引起的蛋白质,称为抗原,该病毒导致新冠COVID-19。本次通告的未经授权的产品在盒子右下角有一个带有白色字母和符号的深蓝色盒子,包括外盒标签上标识的字母“CE”和名称ACON Biotech(杭州)Co.,Ltd。
艾康另一款家用自测试产品Flowflex COVID-19 Antigen Home Test,已经获得了FDA的EUA授权,不在本次通告范围,可以继续使用。
FDA建议措施:
如果您有Flowflex SARS-CoV-2 Antigen Rapid Test(Self-Testing)产品,与上面的包装信息进行对比。不要使用上图深蓝色包装标签的产品。
对于检测使用者和护理人员:如果您认为自己接受了该产品检测,并且对检测结果感到担忧,请咨询您的医护人员。
对于医护人员和测试组织者:如果在两周前使用该产品进行抗原测试,那么如果您怀疑不准确的结果,请考虑使用FDA授权的其它产品重新测试您的患者。如果检测是在两周前进行的,并且没有理由怀疑当前新冠SARS-CoV-2感染,则无需重新检测。
向FDA报告在该产品中遇到的任何问题,包括可疑的错误结果。
FDA监管措施:
FDA定期监控未经授权、未经批准或未经批准的测试的销售情况,包括测试性能或结果问题的报告。FDA已经与艾康ACON Laboratories,Inc.沟通解决这一安全问题。
艾康已开始召回在美国销售的所有未经授权的Flowflex SARS-CoV-2 Antigen Rapid Tests (Self-Testing)该产品。
如果有重要的更新信息,FDA将继续向公众通报。
艾康之前获得另一款产品的FDA授权:
根据小编进一步获得的信息,艾康另一款获得FDAEUA授权的产品包装照片如下:

经过FDA授权的产品包装有“Home Test”(参考翻译:家用测试)字样的与本次被通告的包装明显不同有“Self-Testing”(参考翻译:自测试)。的确,FDA的执法是火眼金睛的。
艾康公告:
在艾康官网,艾康生物3月1日发布了一则公告,可能是对于本次事件的一个处理和回应(根据FDA的披露,艾康在美国召回那些销售的未获授权的产品)。
笔者:要是在艾康在FDA发现之前就发现该问题并发布通告也许就更好了。


来源:医课汇


