您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-28 11:27
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
复宏汉霖“泛癌种”PD-1单抗获批上市。复宏汉霖PD-1斯鲁利单抗注射液(HLX10)获国家药监局批准上市,用于经标准治疗失败的、不可切除或转移性高度微卫星不稳定型(MSI-H)实体瘤。公布于CSCO2021年会上的Ⅱ期临床结果显示,HLX10在这类实体瘤患者中经IRRC评估的客观缓解率(ORR)达到38.2%(2例完全缓解,24例部分缓解)。目前,HLX10用于鳞状非小细胞肺癌的上市申请也正在审评中。
国内药讯
1.传奇CAR-T获CHMP推荐批准。欧洲药品管理局人用药品委员会(CHMP)推荐批准杨森与传奇生物开发的BCMA-CAR-T疗法Carvykti(西达基奥仑赛, cilta-cel)上市,用於治疗既往接受过至少三种治疗(免疫调节药物、蛋白酶体抑制剂和抗CD38抗体)的复发或难治性多发性骨髓瘤成人患者。在关键性Ⅰb/Ⅱ期CARTITUDE-1研究中,cilta-cel达到98%的缓解率和83%的完全缓解率,两年无进展生存率和总生存率分别为61%和74%。今年2月,该新药已在美国获批上市。
2.复星凯特CAR-T拟纳入突破性疗法。复星凯特从吉利德旗下公司Kite引进的CAR-T产品FKC889(Tecartus)获CDE拟纳入突破性治疗品种,用于治疗复发或难治性套细胞淋巴瘤(r/r MCL)。Tecartus是一种靶向CD19的CAR-T,已于2020年7月和12月分别获得FDA和欧盟批准上市,是首个也是唯一一个获批用于r/r MCL的CAR-T细胞疗法。在关键研究ZUMA-2中,中位随访17.5个月时,Tecartus的ORR为92%,CR率为67%。
3.吸入式癫痫急救疗法拟纳入突破性治疗品种。优时比与Alexza公司联合开发的阿普唑仑吸入粉剂(Staccato alprazolam)获CDE拟被纳入突破性治疗品种,用于快速终止12周岁及以上患者的刻板性癫痫长时间发作。Staccato alprazolam是一种药物器械组合,拟通过手持式吸入器将阿普唑仑气溶胶递送至深肺以产生快速的全身作用。目前该疗法正在Ⅲ期临床中评估用于90秒内快速终止癫痫发作以及给药后2小时内无癫痫发作复发的有效性。
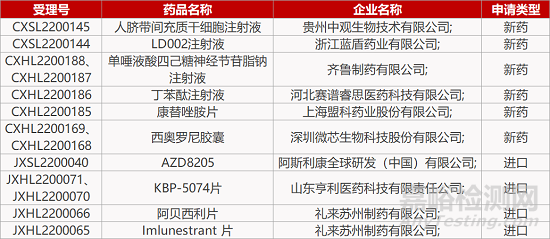
4.阿斯利康B7-H4-ADC在华报IND。阿斯利康治疗用生物制品1类新药AZD8205的临床试验申请获CDE受理。这是一款靶向B7-H4的抗体偶联药物(ADC),由新型拓扑异构酶1抑制剂(TOP1i)—linker—靶向B7-H4的抗体构成。AZD8205旨在将TOP1i弹头递送至B7-H4阳性细胞中,导致DNA损伤和细胞死亡。在一项TNBC PDX肿瘤模型研究中,3.5 mg/kg AZD8205单次IV给药的总缓解率为69%(肿瘤较基线消退≥30%),完全缓解率为9/26(36%)。
5.艾力斯EGFR-TKI肺癌Ⅲ期临床积极。艾力斯医药在ELCC2022大会上公布其自主研发的第三代EGFR-TKI艾弗沙(甲磺酸伏美替尼)一线治疗EGFR敏感突变局部晚期或转移性非小细胞肺癌(NSCLC)的Ⅲ期注册临床(FURLONG)积极结果。与对照组相比,伏美替尼组显著延长中位PFS(20.8个月vs11.1个月),降低疾病进展或死亡风险达56%;而且≥3级不良反应发生率也更低。目前,该新药在国内的上市申请已被CDE纳入优先审评和突破性治疗品种。
6.信达PD-1出海上市遭FDA拒绝。礼来与信达联合宣布,收到FDA针对PD-1信迪利单抗联合培美曲塞和铂类化疗用于非鳞状非小细胞肺癌(NSCLC)患者一线治疗的新药上市申请(BLA)的完整回覆函。FDA建议补充头对头标准疗法(即K药)、以总生存期(OS)为主要终点的非劣效、全球多中心III期临床。在ODAC(肿瘤药物专家委员会)会议上,FDA专家以14比1投票要求信迪利单抗增加对美临床研究,不建议直接批准。
国际药讯
1.诺华CD19-CAR-T新适应症获欧盟支持。欧洲药品管理局(EMA)人用药品委员会(CHMP)推荐批准诺华靶向CD19的CAR-T疗法Kymriah扩展适应症,用于治疗接受过两种以上全身性治疗的复发/难治性滤泡性淋巴瘤患者。在一项国际Ⅱ期临床中,中位随访约17个月时,Kymriah达到86%的总缓解率和69%的完全缓解率。Kymriah是首款获得FDA批准的CAR-T疗法,此前已获得FDA和欧盟批准治疗复发/难治性急性淋巴细胞白血病和弥漫性大B细胞淋巴瘤。
2.罗氏ADC组合获欧盟CHMP支持。欧洲药品管理局人用药品委员会(CHMP)推荐批准罗氏抗体偶联药物(ADC)Polivy(polatuzumab vedotin)与标准治疗方案(R-CHP)联用,一线治疗弥漫性大B细胞淋巴瘤(DLBCL )患者。在一项Ⅲ期临床中,与比利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松(R-CHOP)标准治疗相比,Polivy联合R-CHP显著改善患者的无进展生存期(HR=0.73;95% CI:0.57-0.95;P<0.02)。详细结果已在《新英格兰医学杂志》上发表。
3.创新银屑病外用疗法52周疗效积极。Dermavant公司芳香烃受体调节剂(TAMA)tapinarof乳膏治疗斑块状银屑病的Ⅲ期扩展研究52周数据积极。患者银屑病面积和严重程度指数(PASI)等变化,以及皮肤病学生活质量指数(DLQI)的变化均观察到持续改善,药物总体耐受性良好。FDA去年8月已受理tapinaro乳膏的新药申请,预计2022年第二季度做出回复。在中国,NMPA已批准这款创新疗法上市,名为本维莫德(benvitimod)乳膏。
4.辉瑞RSV疫苗再获突破性疗法认定。FDA授予辉瑞(Pfizer)呼吸道合胞病毒(RSV)疫苗PF-06928316(RSVpreF)突破性疗法认定,用于在60岁以上老年人群中预防RSV导致的下呼吸道疾病。RSVpreF包含融合前(prefusion)F糖蛋白,旨在对RSV A和RSV B两个亚型提供最佳保护。今年3月初,FDA已授予其突破性疗法认定,用于通过产妇的主动免疫,预防从出生到6个月大的婴儿患上RSV相关下呼吸道疾病。
5.Moderna拟开发普通感冒mRNA疫苗。Moderna公司日前宣布,正在准备针对四种冠状病毒(HCoV-229E、HCoV-NL63、HCoV-OC43和HCoV-HKU1)开发候选疫苗mRNA-1287,用于预防这四种病毒感染导致的普通感冒和上呼吸道感染。对于老年人等高危人群来说,病毒感染也可能进一步导致继发细菌感染和肺炎等重疾。全球范围内,10%-30%的上呼吸道感染由这四种病毒引起,在造成普通感冒的病因中占第二位,仅次于鼻病毒。
6.BMS联手罗氏开发AI病理学解决方案。百时美施贵宝与罗氏将利用后者基于AI的图像分析算法,合作开发两种创新数字化病理学算法,用于癌症精准治疗的辅助诊断。根据协议,罗氏将针对VENTANA PD-L1(SP142)图像检测创建数字化算法,用于为BMS直接在临床试验中生成生物标志物数据;罗氏还将把PathAI公司开发的针对CD8生物标志物的分析算法整合到NAVIFY数字病理学软件中,为BMS分析CD8检测染色的临床样本,并生成量化空间生物标志物数据。
医药热点
1.2022年护士执业资格等考试时间推迟。中国卫生人才网3月25日发布关于推迟举行2022年度卫生专业技术资格考试和护士执业资格考试的公告。为切实做好新冠肺炎疫情防控工作,确保广大考生和考试工作人员的生命安全和身体健康,经研究,原定于今年4月9、10、16、17日举行的2022年度卫生专业技术资格考试和4月23、24日举行的2022年护士执业资格考试推迟举行,具体时间将另行通知。
2.临床营养科建设与管理指南出台。国家卫健委日前印发《临床营养科建设与管理指南(试行)》,明确二级以上综合医院以及肿瘤、儿童、精神等专科医院应当设置临床营养科。有条件的医疗机构可开设临床营养科病房,为住院患者提供临床营养诊疗服务。临床营养科的服务包括按需提供医疗膳食、肠内、肠外营养建议或处方;规范指导特殊医学用途食品使用等内容。
3.辉瑞新冠口服药中国售价为2300元/盒。据经视新闻最新报道,辉瑞新冠口服药奈玛特韦片/利托那韦片组合包装(Paxlovid)在浙江投入使用,价格为2300元/盒并纳入医保。3月9日,中国医药已与辉瑞达成合作,将在协议期内(2022年度)负责辉瑞新冠病毒治疗药Paxlovid在中国大陆市场的商业运营。目前,Paxlovid已被纳入第九版《新冠肺炎诊疗方案》。
评审动态

来源:药研发


