您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-22 05:35
肥胖症(obesity)是指在遗传基因、环境因素、缺乏锻炼和饮食不节等多种因素作用下,体内脂肪累积过多和(或)分布异常,导致身体质量增加的慢性代谢性疾病。
近年来,身体质量指数(body mass index, BMI)过高与全球400万人口死亡相关,占全因死亡人数的7.1%。
2017年NEJM发表的GBD研究表示,截至2015年,共有1.077亿儿童和6.037亿成人患有肥胖症;《中国居民营养与慢性病状况报告(2020年)》显示,中国成年居民超重肥胖率超过50%,且城乡各年龄组居民超重肥胖率持续上升。
大量研究证实,肥胖超重是罹患心血管疾病、2型糖尿病、慢性肾病、恶性肿瘤的危险因素,与正常体重的个体相比,BMI处于30-34.9kg/m2的个体,其总死亡率风险提高了40%以上,而BMI超过40kg/m2的个体,其相对死亡率则增加到100%。

图1. 期刊截图,来源:The New England Journal of Medicine
不仅如此,由肥胖带来的“病耻感”会严重影响患者身心健康及社会适应能力,给肥胖人群贴上“懒”、“贪吃”、“不自律”这类标签的偏见不在少数。事实上,早在1948年,世界卫生组织便根据国际疾病分类将肥胖症确定为一种慢性退行性疾病,肥胖症病理生理学的复杂性,使得短期行为干预,如运动、控制饮食、改变不良生活习惯等无法治愈该疾病。因此,往往需要药物介入或外科手术干预。
1 抗肥胖症药物发展史
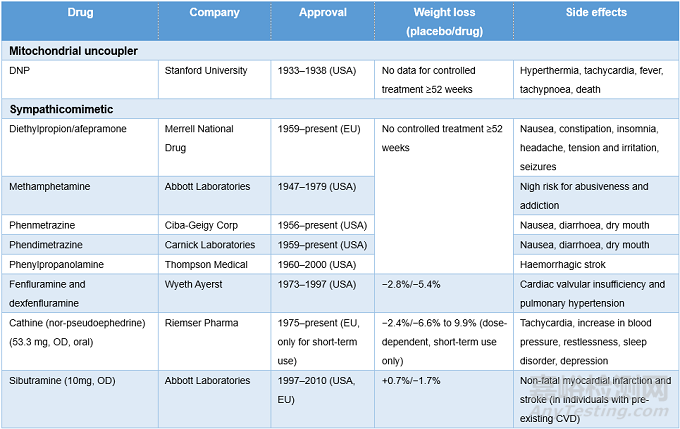
受限于技术和社会因素,抗肥胖症药物(anti-obesity medications, AOMs)的研发一直面临着巨大挑战。回顾历史,AOMs上市后引发了很多安全性问题。
19世纪90年代,羊甲状腺提取物被用于提高甲状腺机能正常患者的代谢率,使脂肪分解加速起到快速减肥的效果,然而治疗增加了心律失常和心脏骤停的风险,且有报道停药后出现甲状腺机能减退。
20世纪30年代,减肥药2, 4-二硝基酚曾风靡一时,但该药会引起严重的不良反应,如粒细胞缺乏症、白内障、皮炎和致命的过高热。
1947年,拟交感神经药物安非他命在美国获批用于减轻体重治疗,虽然通过促进神经系统的去甲肾上腺素和多巴胺的释放抑制了食欲,但该药很快便被证明具有成瘾性。尽管如此,在20世纪50年代,其他拟交感神经药物如芬特明、安菲拉酮依然在被广泛使用。
20世纪40-60年代,曾流行过“彩虹丸”,即联合使用安非他命、洋地黄、利尿剂、泻药和甲状腺激素,并加入巴比妥酸类药物以抵消由兴奋剂引起的紧张和亢进,这种鸡尾酒疗法造成了灾难性的后果,许多病人出现心脏毒性或猝死。
20世纪60年代末,在欧洲销售的安非他命类似物——阿米雷司,其使用引起患者出现了慢性肺动脉高压,死亡率高达50%。
20世纪70年代以来,苯丙醇胺(PPA)被用作感冒药和食欲抑制剂,但其用于抗肥胖治疗则未经许可。由于PPA可导致颅内出血和中风,因此FDA在2005年将其从非处方药中移除。
20世纪80-90年代,芬氟拉明被广泛用作食欲抑制剂;1992年,减肥药芬-芬,即芬氟拉明、芬特明联用,在美国非常流行,但其引起的肺动脉高压和瓣膜病这些致命性的副作用为减肥药的开发埋下了长期的阴影,芬氟拉明及右芬氟拉明遂于1997年撤市。
2008年,FDA和EMA以可能引发抑郁和自杀为由拒绝了利莫那班用于肥胖症的治疗,赛诺菲从而终止了对利莫那班的研究,并停止了其他CB1拮抗剂的开发。
西布曲明最早用于治疗抑郁症,但临床使用中发现其可减轻体重,1999年该药在美国获批用于肥胖症,并于2000年在我国上市。2010年,雅培公司因西布曲明存在潜在的心血管疾病风险将其撤回,我国也于2010年底彻底宣布停止生产使用西布曲明。
目前,由罗氏研发的脂肪酶抑制剂奥利司他是唯一一种获得FDA和EMA批准的用于慢性体重管理的药物。它于1999年获批处方药销售,2007年获批非处方药销售,也是唯一一种FDA批准的非处方减肥药。
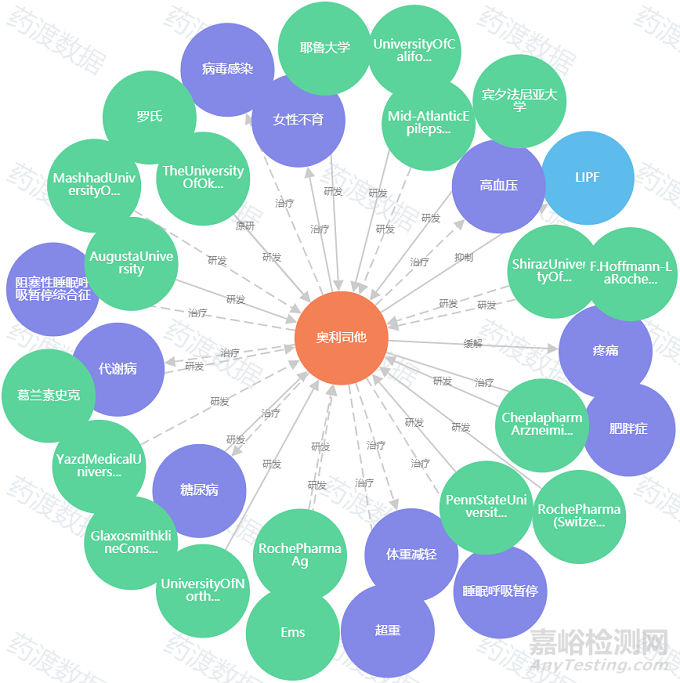
图2. 奥利司他药物知识图谱,来源:药渡数据
奥利司他是一种选择性强的强效胃肠道脂肪酶抑制剂,能够减慢胃肠道中食物脂肪的水解过程,从而减少饮食中25-30%的脂肪水解和吸收,以脂肪泻为最常见的副作用,使用时肝毒性和急性肾毒性的案例也被相继报道。2011年,消费者权益保护组织和药物安全监督机构要求FDA禁用奥利司他。
随着居民生活条件的改善,肥胖俨然已成为我国的公共卫生问题。目前FDA批准的药物中,只有奥利司他能够在我国使用。面对数量日益攀升的超重和肥胖人群,临床用药需求显然未得到满足。
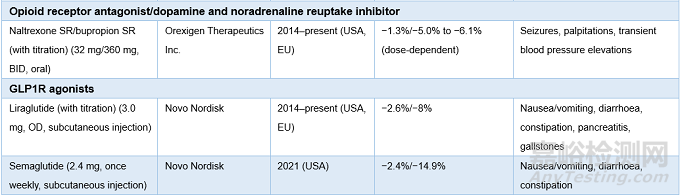
表1. AOMs药物研发历史 ,来源:Nature Reviews Drug Discovery

2 肠促胰素疗法
1 GLP-1相关候选药物
过去的几十年里,肠促胰素生物学的发展以及DPP4抑制剂的成功催生了一系列GLP-1R激动剂。
胰高血糖素样肽-1(GLP-1)是一种肠促胰素,为人体内源性多肽,能减慢胃排空、控制食欲从而减轻体重。但是天然的GLP-1半衰期很短,在体内仅1-2 分钟即被二肽基肽酶4(DPP4)降解而失去活性。
GLP-1受体激动剂(GLP-1RAs),又称GLP-1类似物,是在GLP-1的基础上进行结构修饰,通过改变氨基酸序列和增加脂肪酸长链等,使其不仅可以发挥GLP-1的效应,还可延长作用时间。除了能作用于中枢及胃肠道GLP-1受体(GLP-1R),抑制食欲,减慢胃排空从而使机体摄食、吸收减少以降低体重外,GLP-1ARs还能作用于脂肪组织,通过促进白色脂肪细胞转化为棕色脂肪细胞,使棕色脂肪细胞脂肪分解、产热增加。
图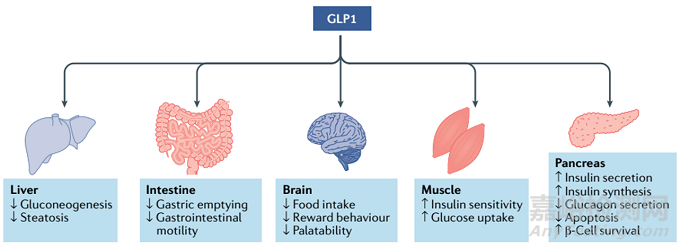
图3. GLP1R激动剂对体重和葡萄糖代谢的调控,来源:Nature Reviews Drug Discovery;
*注:人和哺乳动物体内的脂肪组织可分为白色脂肪组织和棕色脂肪组织。前者为能量仓库,可将多余的能量以脂肪的形式储存;后者通过其细胞内大量的线粒体将食物中的能量转化为热能。
2014年底,利拉鲁肽(liraglutide)成为首个获批用于治疗肥胖的GLP-1R激动剂,剂量约为2型糖尿病(T2D)最高治疗剂量的两倍。用药1年后,据报道,利拉鲁肽组的患者平均体重下降8%,而对照组的患者平均体重下降2.6%。其中,利拉鲁肽组约2/3的患者体重下降超过5%,1/3的患者体重下降超过10%,然而对照组体重下降5%与10%的患者占比仅为27%和11%。
2021年6月,索玛鲁肽(semaglutide)获批用于成人肥胖或超重的慢性体重管理。在一项为期1年的II期临床研究中,每日皮下注射索玛鲁肽0.2mg及以上,在第52周时,受试者的平均体重减少11.2%-13.8%,利拉鲁肽组(3.0mg)减少7.8%。该研究一半的受试者每日用药后可减重15%,且1/3的人群可减重20%。在最近的一项针对非糖尿病超重患者的III期临床试验中,每周注射一次索玛鲁肽(2.4mg),在治疗68周后,患者体重下降了14.9%,明显优于安慰剂组(2.4%)。
其他的几种肽类和小分子GLP-1RAs目前正处于临床开发阶段,包括口服制剂的研究。口服GLP-1R激动剂GLPR-NPA,当前由礼来公司进行III期临床试验。
在临床实践中,GLP-1ARs最常见的不良反应为胃肠道不良反应,表现为恶心、呕吐、腹泻、腹胀等症状,这些症状一般随着治疗时间的延长而逐渐减轻或耐受,使用时可从小剂量起始,逐渐加量。
2 基于肠促胰素的多重激动剂
药理学研究已证实,哺乳动物通过远不止一种激素来调控机体能量平衡,同时针对GLP-1、GIP和/或胰高血糖素受体的多重激动剂(poly-agonists)的发现为该方向取得了突破性进展,多个候选药物已进入临床开发阶段,其中,部分长效GIPR/GLP-1R共激动剂的II期临床结果已被披露。在一项为期12周的T2D患者II期临床研究中,与安慰剂相比,皮下注射NN9709可降低血糖、体重和总胆固醇。不过,与剂量滴定(是指治疗过程中根据患者的响应进行用药剂量的调整,比如从0.2毫克加到0.5毫克)的利拉鲁肽相比,NN9709对体重的改善并无统计学差异。鉴于索玛鲁肽在III期临床试验中的疗效,2020年终止了对NN9709的开发。
泰瑞帕肽是由礼来开发的一种每周一次的葡萄糖依赖性促胰岛素多肽(GIP)受体和GLP-1受体双重激动剂。在一项针对T2D患者的III期临床研究中,与注射特定的单一GLP-1R激动剂相比,26周后,泰瑞帕肽治疗组患者的糖化血红蛋白和体重较基线显著下降。使用最高剂量对患者的血糖控制作用异常强烈,近1/3的受试者减重超过10%。
最近一项针对T2D超重患者的III期临床试验表明,与索玛鲁肽(1mg)相比,在所有测试剂量下泰瑞帕肽均表现出了良好的效果:治疗40周后,泰瑞帕肽组29%-51%(索玛鲁肽组:20%)的患者糖化血红蛋白降低至5.7%以下,15-40%的患者(索玛鲁肽组:9%)减重超过15%。

图4. 泰瑞帕肽与索玛鲁肽对T2D超重患者体重的影响,来源:The New England Journal of Medicine
GLP-1R和胰高血糖素受体(GcgR)双重激动剂旨在通过抑制食欲、增加产热和脂肪分解等多机制控制体重且最大限度地降低高血糖风险。Cotadutide是一种棕榈酰化的GLP-1R/GcgR双重激动剂,由阿斯利康研发,一项为期54周的IIb期临床研究纳入了患有T2D的超重和肥胖患者,与安慰剂组相比,cotadutide降低了病人的体重和肝脏脂肪含量,并改善了糖耐量。患者平均体重降低约5%,15.5%的患者减重超过10%。
LY3437943是一种GIP/GcG/GLP-1三重激动剂,每周用药一次,针对T2D患者的I期临床研究结果表明,治疗12周后,与泰瑞帕肽相比,LY3437943组体重减轻更为明显。
3 瘦素、瘦素增敏剂和MCR4激动剂
1994年,瘦素的发现加深了人们对外周激素如何向大脑发送信号以调节能量平衡的理解。瘦素的缺失会导致严重的代谢紊乱,如暴饮暴食、脂肪营养不良和下丘脑性闭经。
美曲普汀于2014年获FDA批准,2018年获EMA批准用于治疗脂肪营养不良,其有效成分为一种重组人瘦素类似物,补充瘦素以期使先天性瘦素缺乏症和神经性厌食症患者的代谢和神经内分泌改变正常化。然而,尽管补充瘦素对先天性瘦素缺乏症的个体有效,但对多基因肥胖症患者减重作用不大。
瘦素通过激活弓状核(ARC)中的POMC神经元来调节能量代谢并抑制同一区域的AgRP神经元。POMC神经元投射到室旁核(PVN),在该区域通过激活大脑MC4R来诱导饱腹感。
尽管MC4R是公认的肥胖症治疗靶点,但开发具有选择性且安全的MC4R激动剂极具挑战。MC4R激动剂容易交叉刺激结构相关的MC1、MC3和MC5受体,这些受体在多种神经内分泌过程中发挥重要作用,包括毛发和皮肤色素沉着、能量稳态和红细胞分化。
此外,激活MC4R可以通过激活交感神经系统提高男性的血压和心率,引起性唤起。过去的30年来,多种MC4R激动剂,如礼来的LY2112688、诺和诺德的MC4-NN-0453、默克的MK-0493和阿斯利康的AZD2820已进行临床试验,但均因减肥不足或上述不良反应而停止使用。
值得一提的是由Rhythm Pharmaceuticals公司开发的MC4R激动剂setmelanotide不会影响人体心率和血压,该药III期临床研究中,在先天性缺乏POMC或LEPR的患者身上表现出良好的耐受性,体重减轻明显且无严重不良反应;2020年11月,FDA批准其用于治疗POMC、PCSK1或LEPR缺乏症患者的肥胖情况。
4 胰淀粉样多肽
胰淀粉样多肽(IAPP)是一种与胰岛素共同分泌的肽类物质,其可致机体厌食的潜能催生了普兰林肽(pramlintide)。普兰林肽已获FDA批准用于TID和T2D患者,重要的是,普兰林肽在减少食物摄入量和降低体重方面的作用并不局限于糖代谢受损的患者。因此,其他相关药代动力学改善的胰淀粉样多肽类似物,也被归入AOMs中。
5 胃饥饿素
胃饥饿素是胃底x/a样细胞分泌的一种肽类激素,作用于下丘脑摄食中枢,刺激食物摄入。由Cyto生物技术公司开发的减少酰基胃饥饿素的治疗性肽疫苗——CYT009-GhrQb,已进入早期临床研究阶段,但其对体重和摄食并无影响。安进公司在DIO小鼠中测试了一种特异性的抗胃饥饿素单克隆抗体,但并未发现对体重和摄食产生长期有益的影响。
6 靶向线粒体解偶联剂
线粒体是人体细胞最重要的细胞器之一,是细胞内氧化磷酸化和形成ATP的主要场所。解偶联剂是针对线粒体膜电位的一种氧化磷酸化抑制剂,可刺激线粒体耗氧并促进糖、脂肪、蛋白质的消耗。
2006年,Spiegelaman提出解偶联剂可在一定的安全剂量下用于治疗肥胖相关的代谢综合征。2, 4-二硝基苯酚(DNP)曾是最受关注的弱酸质子解偶联剂,并首次以线粒体为靶标治疗肥胖。然而,DNP的用量受限,因为解偶联过程中产生热量会使体温大幅升高并引起致命的过高热。DNP的有效剂量与有毒剂量很接近,使其很容易因过量服用而引起严重的副作用。
BAM15是一种口服线粒体质子载体解偶联剂,可增加营养物质的氧化作用,并降低体脂量,而不会改变食物摄入量、肌肉量和生理相关指标,具有强大的抗肥胖作用和胰岛素增敏作用。
表2. AOMs研究进展(来源:Nature Reviews Drug Discovery)
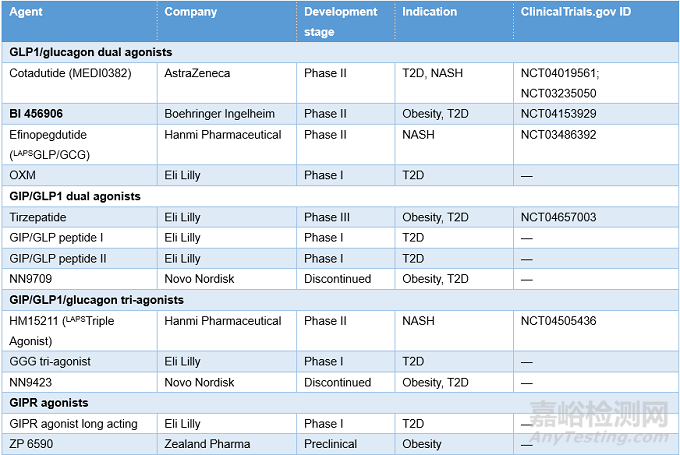

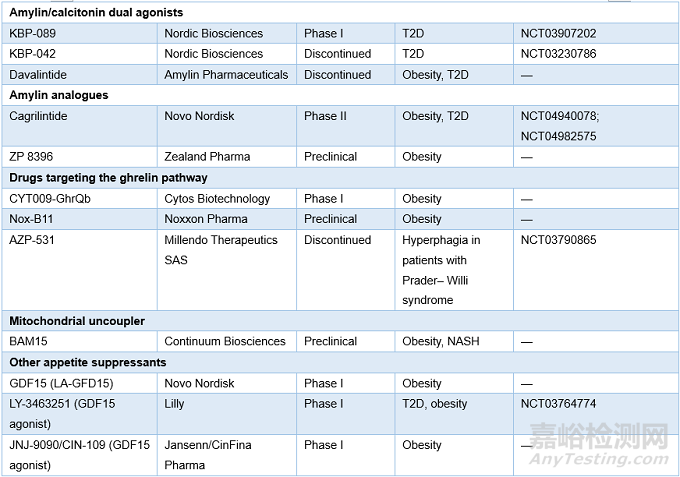
7 结论
肥胖症的药物研发历程充满坎坷,截至目前,真正进入临床阶段且取得显著疗效的药物寥寥无几,阻碍新药开发的障碍是肥胖症所涉及通路的复杂性,以及将临床前数据转化为人体研究的局限性。随着超重和肥胖的人数越来越多,人们对肥胖症及相关疾病的危害越来越重视。
减肥药物研发与部署成功的关键在于寻找适当的风险-效益平衡,以及对食欲和代谢机制更加深入的理解。监管机构和制药行业必须共同朝着一个临床范式努力,即探索新一代可成药靶点,开发下一代靶向疗法。此外,鉴于调节能量稳态的因素之间复杂的相互作用,更有效的治疗模式可能会涉及多个途径的同时靶向,从而最大限度地提高减肥药的安全性和有效性。
参考文献
1. Muller, T. D.et al. Anti-obesity drug discovery: advances and challenges. Nature Reviews Drug Discovery. 21, 201-223 (2022).
2. Frias, J. P. et al. Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes. N. Engl. J. Med. 385, 503–515 (2021).
3. O’Neil, P. M. et al. Efficacy and safety of semaglutide compared with liraglutide and placebo for weight loss in patients with obesity: a randomised, double-blind, placebo and active controlled, dose-ranging, phase 2 trial. Lancet 392, 637–649 (2018).
4. Gilbert W. K. et al. New advances in models and strategies for developing anti-obesity drugs. Expert Opin Drug Discov. 2013, 8(6): 655–671.
5. 王璐,张怡俊,朱晓萍等. 肥胖症病人病耻感的质性研究.
6. 关晖勇,谭玉燕,关芬海. 肥胖症多学科管理和治疗方案的构建与实施效果.
7. 何文欢,王存川,高丽莲等. 肥胖代谢外科手术患者病耻感的研究进展.
8. 毛亚娇,张广意,俞永涛等. 领悟社会支持在肥胖症患者病耻感与生活质量间的中介作用.
9. 崔家玉,谢晓慧. 肥胖症的药物治疗进展.
10. 关紫菀. GLP1R基因多态性对2型糖尿病患者应用GLP-1受体激动剂疗效和不良反应的影响研究.
11. 金甲,张凤,杨玲玲等. 线粒体解偶联剂的研究进展.

来源:药渡


