您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-25 11:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内首个TIL药物获批实体瘤临床。苏州沙砾生物自主研发的1类生物药GT101注射液(受理号:CXSL2200061)获国家药监局临床试验默示许可,拟开发用于转移或复发性实体瘤的治疗。GT101是国内首个获批临床的肿瘤浸润淋巴细胞(TIL)药物,已在前期研究者发起的临床试验中展现出良好的药物安全性和明显的肿瘤杀伤及临床疗效,有望成为黑色素瘤、宫颈癌、非小细胞肺癌等实体瘤的重要治疗手段。
国内药讯
1.徐诺HDAC抑制剂Ⅱ期研究将亮相ASCO。徐诺药业口服泛HDAC抑制剂艾贝司他将在ASCO2022年会上公布用于治疗复发/难治滤泡性淋巴瘤(r/r FL)的中国Ⅱ期临床最新数据。艾贝司他是徐诺药业的首款候选药物,目前正在全球同步临床开发,适应症涉及肾细胞癌和非霍奇金淋巴瘤。此前FDA已授予该新药两个快速通道资格,单药4线治疗r/r FL,以及与培唑帕尼联用治疗肾细胞癌经治患者。
2.阿斯利康/第一三共ADC拟纳入优先审评。阿斯利康与第一三共联合开发的HER2-ADC新药注射用trastuzumab deruxtecan(Enhertu)的上市申请获CDE拟被纳入优先审评,用于不可切除或转移性HER2阳性成人乳腺癌患者。值得一提的是,该新药刚刚在中国被纳入突破性治疗品种。在美国,Enhertu已获得FDA批准三线治疗HER2阳性、无法切除或转移性乳腺癌经治患者,以及治疗既往接受过曲妥珠单抗治疗的HER2阳性局部晚期或转移性胃癌和胃食管结合部腺癌患者。
3.荣昌新型PD-L1单抗获批I期临床。荣昌生物新型PD-L1单抗注射用RC98获国家药监局临床默示许可,拟开展一项I期临床研究,评估与HER2-ADC维迪西妥单抗联合治疗HER2表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)的安全性、耐受性、药代动力学特征和初步的临床疗效。维迪西妥单抗是荣昌生物自主研发的首个国产ADC药物,已获批用于单药治疗胃癌和尿路上皮癌。
4.天晴康方与轩竹生物开展联合用药研究。中生制药联营公司天晴康方的PD-1单抗派安普利将联合轩竹生物的AXL抑制剂开展联合用药临床试验,评估这一组合治疗非小细胞肺癌等实体瘤的有效性和安全性。GAS6-AXL信号通路作为促进肿瘤生长及转移、肿瘤免疫逃逸与药物耐受的关键通路之一,被认为是癌症治疗的新靶点。目前,轩竹生物的这款小分子药物正在北美地区进行I/II期临床研究。
5.恒瑞2021年财报发布。4月22日,恒瑞公布2021年财务报表,全年营业收入259.05亿元,同比减少 6.59%;归属于上市公司股东的净利润45.3亿元,同比减少28.41%;研发投入62.03亿元,同比增长24.34%,占营业收入的比重达到23.9%。报告期内,恒瑞的肿瘤领域产品销售达到130.71亿元,同比减少14.39%;造影剂产品销售额为32.7亿元,较去年减少9.93%;麻醉产品收入49.16亿元,同比增长7.91%。
国际药讯
1.罗氏CD20/3双抗获欧盟CHMP支持。罗氏CD20/CD3双抗mosunetuzumab获欧盟EMA人用药品委员会(CHMP)推荐有条件批准上市,用于治疗既往接受过两种前期疗法的复发或难治性滤泡性淋巴瘤。在一项Ⅰ/Ⅱ期临床GO29781中,中位随访为18.3个月时,患者的完全缓解率达到60%(n=54/90),客观缓解率为80%(n=72/90)。此前,它已获FDA授予用于相同适应症的突破性疗法认定。
2.辉瑞新冠口服药进WHO治疗指南。4月22日,WHO更新COVID-19治疗指南,推荐辉瑞新冠口服药Paxlovid(nirmatrelvir+ritonavir)用于治疗具有高住院风险的轻中度新冠肺炎患者。两项随机对照试验的最新数据显示,接受Paxlovid治疗后,患者住院的风险降低了85%。此外,WHO还更新吉利德remdesivir(瑞德西韦)的推荐指南,认为可有条件用于具有住院高风险的轻中度新冠肺炎患者。
3.阿斯利康长效新冠鸡尾酒研究见刊NEJM。阿斯利康在《新英格兰医学杂志》上发表其长效抗体鸡尾酒疗法Evusheld(tixagevimab与cilgavimab)用于有症状COVID-19的暴露前预防的III期临床PROVENT研究成果。6个月随访数据显示,一次性肌肉注射Evusheld使症状性COVID-19风险降低83%,且耐受性良好。去年12月,Evusheld已获得FDA紧急使用授权,用于在接触病毒之前预防COVID-19感染。
4.施维雅艾伏尼布治疗AML研究见刊NEJM。施维雅在《新英格兰医学杂志》上发表口服IDH1抑制剂艾伏尼布(拓舒沃)联合阿扎胞甘用于一线治疗IDH1突变、急性髓系白血病(AML)的III期临床AGILE积极结果。与阿扎胞甘联合安慰剂相比,艾伏尼布与阿扎胞甘联合显著改善患者的无事件生存期EFS(风险比[HR]=0.33,[95% CI: 0.16,0.69],单侧P值=0.0011),显著改善患者的总生存期OS(HR = 0.44,[95% CI: 0.27, 0.73], 单侧P值=0.0005)。施维雅目前正在与FDA等药监部门就该新适应症申请展开沟通。
5.创新粘菌素吸入疗法获突破性疗法认定。Zambon公司基于粘菌素前体药物CMS与雾化器I-neb结合的吸入式疗法CMS I-neb获FDA授予突破性疗法认定,用于减少铜绿假单胞菌定植的非囊性纤维化支气管扩张症(NCFB)患者的肺恶化发生率。在一项Ⅲ期临床PROMIS-i中,相比安慰剂,CMS I-neb组患者疾病急性加重的年发生率显著减少(0.58比0.95,RR: 0.61,95% CI 0.46-0.82,p=0.00101)。粘菌素是目前针对多重耐药革兰阴性菌仍然具有活性的少数抗菌药物之一。
6.BDNF疗法治疗听力损失Ⅱa期临床积极。Otonomy公司脑源性神经营养因子(BDNF)配方疗法OTO-413在治疗听力损失的Ⅱa期临床结果积极。与安慰剂相比,单次鼓室内注射OTO-413在第57天和第85天时显著改善患者的听力检测。两组三项噪声言语(SIN)听力测试中至少一项获得显著改善的患者比例分别为40%和20%;整体印象变化量表(PGIC)指标显著改善的患者比例分别为50%和10%。
7.PI3K抑制剂加速审批需补充RCT研究。FDA肿瘤咨询委员会(ODAC)在重新审查吉利德Zydelig (idelalisib),拜耳copanlisib,Secura Bio的develisib和TG 公司Ukoniq (umbralisib)这四款PI3K抑制剂的加速批准和毒性问题后,以16:1的投票结果赞成需要随机对照试验来支持该类药物在血液恶性肿瘤领域的加速批准。FDA血液系统恶性肿瘤部门主任Nicole Gormley表示,加速批准途径并不等同于单臂试验。随机试验可以为早期疗效终点和后期无进展生存期终点提供动力,从而加速批准。
医药热点
1.1233家医院入选“千县工程”名单。国家卫健委印发《“千县工程”县医院综合能力提升工作县医院名单》,全面启动“千县工程”县医院综合能力提升工作。经过2轮复核,共有1233家县医院参与“千县工程”县医院综合能力提升工作。国家卫健委将对纳入“千县工程”的县医院进行动态管理,结合全国县医院医疗服务能力年度评估情况和各地工作进展情况,适时调整县医院名单。
2.胡盛寿院士再任云南省阜外心血管病医院总院长。4月22日,云南省人民政府发布关于胡盛寿同志任职的通知,省人民政府决定:胡盛寿聘任为省阜外心血管病医院总院长(聘期五年)。胡盛寿,男,1957年出生,中国工程院院士,国家“973项目”首席科学家。现任国家心血管病中心主任,中国医学科学院阜外医院院长,心血管疾病国家重点实验室主任,国家心血管疾病临床医学研究中心主任,《中国循环杂志》主编,法国医学科学院外籍院士。
3.重症医学专家马晓春赴上海支援。受到国务院联防联控机制医疗救治组委派,近日,中国医科大学附属第一医院重症医学科主任马晓春带领团队紧急奔赴上海,支援新冠肺炎重症患者的医疗救治工作。马晓春是国务院新冠肺炎联防联控机制医疗救治组专家,此前先后奔赴黑龙江省、吉林省、河北省、新疆维吾尔自治区、江苏省等9省份17市指导当地重症新冠肺炎救治工作。
4.国家卫健委将ECMO纳入限制类技术。国家卫健委日前印发《国家限制类技术目录(2022年版)》和《国家限制类技术临床应用管理规范(2022年版)》,将国家限制类技术目录从15项调整为12项,并明确国家限制类技术对应的疾病诊断与手术操作编码。新版《目录》删除了同种异体皮肤移植、肿瘤深部热疗和全身热疗、人工智能辅助诊断、颅颌面畸形颅面外科矫治、口腔颌面部肿瘤颅颌联合根治5项技术,并新增体外膜肺氧合(ECMO)和自体器官移植2项国家限制类技术。
评审动态
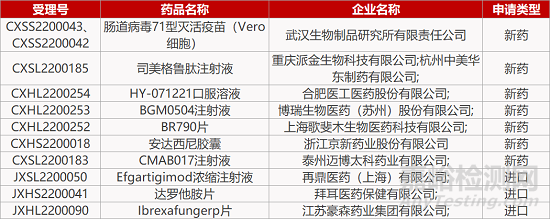
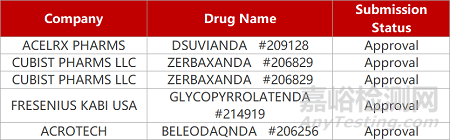

来源:药研发


