您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-29 14:32
摘 要
根据近年来国家出台的一系列政策分析,国家有意的缩紧仿制药销售市场,推动国内企业去创新,然而创新药成本高、风险大、时间长的特点让大多数企业望而止步;改良型新药介于创新药与仿制药之间,属于新药范畴,在风险、成本、时间方面要远低于创新药,对于很多企业来说也许是一个非常好的选择。
在改良型新药的具体分类中,2.2类改良型新药主要针对剂型的改进,在技术难度和临床成本方面与仿制药非常接近。对于还未涉入新药领域的企业来说,选择这一类新药开发或许是一个很好的过渡阶段。然而2.2类改良型新药在立项面临的最大问题就是:如何判断剂型的改进具有明显的临床优势,笔者认为从国内2.2类该良型新药的申报情况分析,或许能得到一定的参考。
一、2.2类新药申报情况统计
目前为止(2016.3.4-2019.11.4)CDE一共受理119个2.2类改良型新药受理号,按照国产新药申报上市、国产新药申报临床、进口申报临床以及进口补充申进行统计。具体情况如下表:
表1 2.2类国内申报情况统计表

在这119个受理号中,国产新药申报共有87个受理号,其中国产新药申报上市23个,国产新药申报临床64个,国产新药申报情况在一定程度上能够反映出目前国内研发方向。分析这些药物的申报情况,对把控这一类药物的申报尺度具有一定的参考意义,故以国产新药申报情况进行分析。
二、国产新药上市申报情况分析
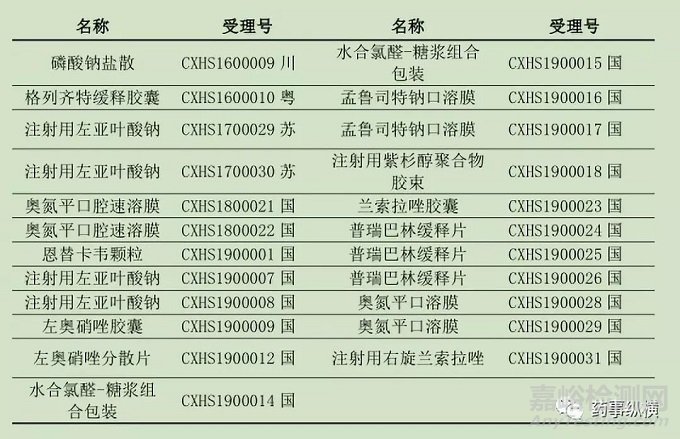
上市申报是指申报生产的这一阶段,已经完成了相关的临床试验,在剂型改进方面已经得到了药审中心的认可,分析这些产品的改进途径对后续的立项具有一定的指导意义。目前2.2类改良型新药已有23个受理号进入上市申请,具体见下表:
表2 2.2类国产新药国内申请上市情况汇总表
备注:
1、2.2类和2.4类同时申报的产品,在很大程度上依赖于2.4类(改变或增加适应症)来体现临床优势,故这里不对其进行分析。
2、上述申报的23个受理号,均是在2016年以前已经申报临床,与现在的审评尺度可能不同,然而考虑上述品种中,有些已经完成现场核查和进入发补阶段,笔者认为在立项方面还是有一定的参考价值,故对其进行统计分析。
根据这23个受理号的申报情况分析,其中6个受理号为注射剂,6个为口溶膜,剩余的包括片剂、胶囊、颗粒剂以及缓释片等剂型,总共涉及13个产品,按照其改进途径分为给药途径、肿瘤药物、儿童用药、剂型改进等方式进行分析和统计,结果见下表:
表3 国产新药上市申请改进途径分析
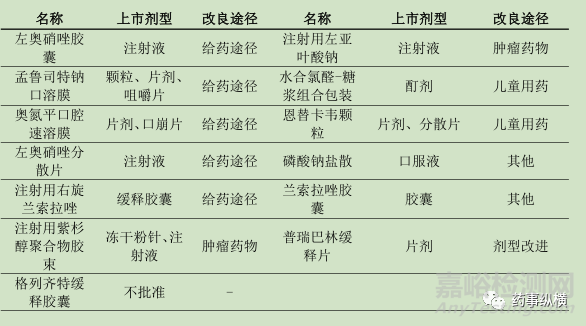
根据上述结果可知,5个产品涉及改变给药途径的改进;2个产品为儿童用药,并且都进入优先审评;2个肿瘤药物的剂型改变;1个产品新剂型的改进;其余2个产品难以判断改进途径。
三、国内临床申请情况分析
2.2类改良型新药属于新药范畴,申报过程按照“两报两批”的模式进行申报,在申报临床过程中,药审中心会对新药的立项进行初步评估,如果产品能够被批准临床,且企业能完成相应临床实验,相信在批生产时,不会再纠结立项问题。在这64个申报临床申请的国产新药受理号中,确定已有24个受理号获得临床批件,具体如下:
表4 2.2类国产新药批准临床药物统计表
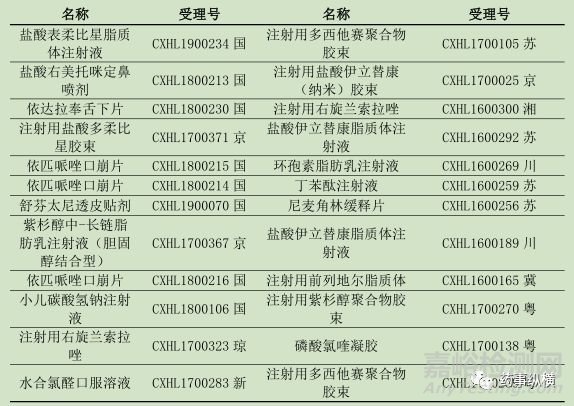
备注:由于后期审评结论不再公开,审评结论为“无”,有可能批准临床也可能不批准,为了不出现误导,不纳入统计分析。
从上述结果中分析, 24个受理号中,其中15个受理号关于注射剂的改良,剩余的包括片剂、凝胶、口服液、鼻剂等剂型,一共涉及19个药物。根据不同的改良途径,按照给药途径、肿瘤药物、剂型优势、儿童用药等类型统计,具体信息如下表:
表5 国产新药临床申请改进途径分析
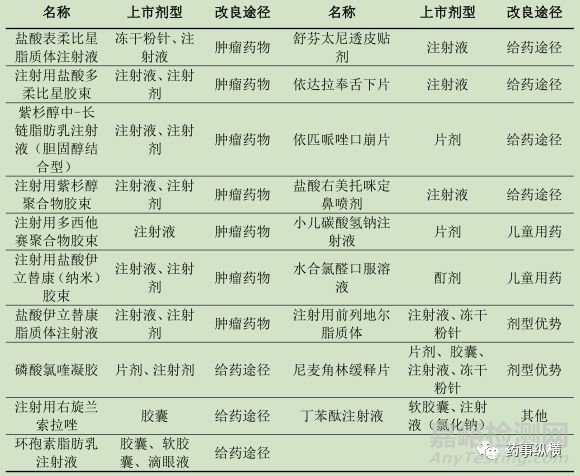
从上述结果可知:
肿瘤药物一共涉及7个药物,均为注射给药途径,剂型改进途径集中在脂质体、胶束等方向;
给药途径一共涉及7个药物,3个药物从注射给药途径改成非注射给药途径,2个药物从非注射给药途径改成注射剂,1个药物由口服和注射途径改成外用制剂,1个药物从口服制剂改成口崩片;
儿童用药涉及2个药物,分别是口服改成注射剂和外用改成口服制剂;
剂型优势涉及2个药物,主要是粉针剂改成脂质体粉针剂以及速释片改成缓释片。
四、结果分析
根据目前2.2类改良型新药申报情况分析,国产新药改进方向主要体现在给药途径、肿瘤药物、儿童用药、剂型优势等4个方面。
改变给药途径是剂型改变的主要方向,针对药物的特点改变给药途径,在疗效和副作用方面往往能得到较大的改善,这一方面临床优势较为明确,也容易得到药审中心的认可,一般遵循着往副作用小的剂型改进,比如注射剂改口服,口服改外用等。当然根据药物自身的特点,也可以反向改进,比如右旋拉索拉唑钠从缓释胶囊剂改成冻干粉针剂。
肿瘤药物是近年来最为关注的一类药物,国家于2017年12月发布的食药监药化管〔2017〕126号(总局关于鼓励药品创新实行优先审评审批的意见)文件中,明确将肿瘤药物纳入优先审评范围,目前肿瘤药物改良主要体现在提高药物在靶向部位的浓度,以及减小药物的副作用方面,例如紫杉醇水溶性差,不稳定等性质,开发出相应的脂质体、胶束、白蛋白结合物、纳米药物等多种剂型,以提高紫杉醇在靶向部位的浓度,同时减少副作用,这一领域改进往往伴随着新的剂型改进。
儿童用药也被纳入优先审评范围,从目前申报的儿童药物来看,主要是剂型方面的改进,提高患者的顺应性,在疗效和副作用方面难以体现出显著的优势。
剂型优势主要体现在同一给药途径下,通过改良成更先进的剂型,达到提高药物疗效或者减小副作用的目的,比如速释制剂改成缓控释制剂,注射液改成脂质体等。
五、结论
最后,2.2类改良型新药主要针对制剂的改进,进入该领域门槛不高,开发难度和成本相对较低,国内大多数企业都有开发这一类药物的实力。从目前2.2类改良型新药的申报情况来看,主要集中在肿瘤药物、给药途径、儿童用药、剂型改进四个方面,在立项2.2类改良型新药时,不防向这四个方向靠拢,结合药物的自身特点,应该能够提高成功的机会。

来源:Internet


