您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-16 11:51
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
艾贝乐FIC免疫疗法上Ⅰ期临床。艾贝乐医药CDH17xCD3双特异性T细胞接合器ARB202用于治疗晚期胃肠道癌症患者的Ⅰ期临床在澳大利亚完成首例患者给药。ARB202是一款潜在“first-in-class” CDH17/CD3双抗,能有效增强T细胞与表达CDH17的胃肠道肿瘤细胞系之间的相互作用,促进T细胞的活化并释放IL-2,以产生肿瘤细胞杀伤。预计艾贝乐医药年内将向NMPA和FDA申报临床试验。
国内药讯
1.神州细胞CD20单抗Ⅲ期临床积极。神州细胞新型CD20单抗瑞帕妥单抗(SCT400)联合化疗治疗弥漫大B淋巴瘤(DLBCL)的关键Ⅲ期研究成果发布在Hematological Oncology上。与利妥昔单抗联合CHOP治疗方案相比,瑞帕妥单抗联合CHOP的一线治疗效果达到非劣效标准:两组经IRC评估的ORR分别达到94.5%和94.1%,CRR分别为70.5%和75.4%;两组间的1年无进展生存期(PFS:81.1%和83.2%)及3年总生存期(OS:81.0%和82.8%)均无显著差异。此外,两组总体安全性相似。
2.微芯降糖新药联合治疗临床进展。微芯生物1类新药西格列他钠在一项关键Ⅲ期临床RECAM完成全部受试者随机入组。该项研究由北京大学人民医院牵头开展,旨在评价西格列他钠联合二甲双胍对经二甲双胍单药控制不佳的2型糖尿病患者的有效性和安全性。西格列他钠是全球首款获批治疗2型糖尿病的PPAR全激动剂,已获CDE批准用于单药改善成人2型糖尿病患者的血糖控制。
3.特科罗双靶点新药获批皮炎临床。嘉兴特科罗自主开发的JAK1/Tyk2双靶点抑制剂小分子外用药TDM-180935获FDA临床许可,拟用于特应性皮炎(AD)的治疗。TDM-180935在抑制特应性皮炎急性期的特征性Th2免疫反应的同时,也能抑制慢性期参与发病的Th1和Th17免疫反应,从而有效阻断特应性皮炎发病的各条通路。在临床前三种特应性皮炎动物模型上,TDM-180935均显现出剂量相关性疗效。
4.奥达长效降糖新药获批临床。成都奥达生物1类创新药Exd391209注射液获国家药监局临床默示许可,拟用于2型糖尿病的治疗。奥达生物特有的氨基酸长效化修饰技术,能够对原有的多肽药物GLP-1受体激动剂进行“升级”处理,通过突变肽链关键位点,降低多肽酶解率、延长药物血浆半衰期,满足周给药甚至双周给药;而且该技术与PEG修饰及基因工程合成IgGFc段修饰等技术手段相比,具有毒性低、成本显著降低等优势。
5.药捷安康双靶点创新药获批实体瘤临床。药捷安康1类化药AXL/FLT3抑制剂TT-00973获国家药监局批准,拟开展Ⅰ期临床首次人体研究,评估用于晚期实体瘤的安全性、耐受性、药代动力学和初步疗效。TT-00973旨在抑制AXL信号通路,来治疗复发及难治性血液系统恶性肿瘤;以及抑制FLT3突变,有望克服既往第一、第二代FLT3-ITD抑制剂治疗的急性髓系白血病(AML)患者的获得性耐药性。在美国,该药已获批开展针对AML和骨髓增生异常综合征的Ⅰ期临床。
6.恒瑞HRS-5965片获批肾病临床。恒瑞医药1类新药HRS-5965片获国家药监局临床试验默示许可,拟开发适应症用于IgA肾病、特发性膜性肾病、C3肾病和狼疮性肾炎等补体参与介导的原发性或继发性肾小球疾病的治疗。HRS-5965片可改善免疫复合物沉积导致的肾小球炎症。在临床前大鼠肾炎模型中,该新药显示出显著的治疗潜力,且安全性良好。
国际药讯
1.Enhertu治疗的伴随检测获FDA批准。FDA批准Guardant Health基于下一代测序(NGS)技术开发的Guardant360 CDx液体活检测试,用于识别携带HER2激活性突变的无法切除或转移性非小细胞肺癌(NSCLC)患者,作为阿斯利康与第一三共联合开发的HER2-ADC新药Enhertu的伴随检测,帮助医生筛选能够受益于这款新治疗选择的NSCLC患者。Guardant360 CDx液体活检能够在一周内提供基因组测试结果,较一般以组织为样品的检验节约一周时间。
2.神经疾病创新诊断产品在欧盟获批。SyncThink公司开发的1类医疗器械大脑检测产品EYE-SYNC获欧盟CE认证,这是一款AI驱动的眼动追踪诊断产品,以测量和量化反映神经损伤或疾病(多动症、自闭症等发育疾病,或帕金森病等神经退行性疾病,以及脑震荡、睡眠剥夺等疾病)的眼动生物标志物,帮助医生评估患者大脑健康,并提供优化的治疗。此前,该产品已获FDA批准用于检测和诊断脑震荡、轻度创伤性脑损伤和视力障碍。
3.FIC抗衰老眼科药物Ⅱ期临床积极。UNITY Biotechnology公司开发的细胞凋亡抑制蛋白Bcl-xL抑制剂UBX1325,在治疗糖尿病性黄斑水肿的Ⅱ期临床BEHOLD最新数据积极。在单次注射12周和18周的时间节点,UBX1325组患者的平均最佳校正视力(BCVA)较基线增加的ETDRS视力表字母分别为4.7个和6.1个,而假性注射组患者这一数值分别为 1.3个(p=0.1148)和1.3个(p=0.0368);期间UBX1325组患者亦维持其黄斑中心凹视网膜厚度(CST)。此外,UBX1325总体耐受性良好。
4.CRISPR基因编辑疗法获批DMD临床。FDA批准非营利机构Cure Rare Disease(CRD)开发的CRISPR基因编辑疗法CRD-TMH-001的IND申请,拟用于一次性静脉注射治疗杜氏肌营养不良症(DMD)。CRD-TMH-001主要针对编码抗肌萎缩蛋白的基因在启动子或外显子1产生突变的患者,它通过基因编辑手段上调一种抗肌萎缩蛋白异形体(isoform)的表达,以此来稳定、甚至逆转DMD病情进展。
5.大熊自免双靶点创新药获FDA临床许可。大熊制药拟开发用于治疗自身免疫性疾病的双靶点抑制剂DWP213388的IND申请获FDA批准,即将在80名健康受试者中开展Ⅰ临床,评估DWP213388的安全性、药代动力学和药效动力学反应。DWP213388能选择性地抑制布鲁顿酪氨酸激酶(BTK)和白细胞介素-2诱导型T细胞激酶(ITK),已在多个临床前模型中显示出能够安全有效地预防或减少自身免疫性疾病的症状。
6.罗氏与Cend达成联合用药临床合作。Cend公司创新环肽药物CEND-1拟与罗氏PD-L1检查点抑制剂Atezolizumab开展联合治疗转移性胰腺导管腺癌(mPDAC)的Ib/II期临床(Morpheus)试验。该项研究将评估Atezolizumab/CEND-1/吉西他滨/白蛋白紫杉醇vsCEND-1/吉西他滨/白蛋白紫杉醇方案或单独的吉西他滨/白蛋白紫杉醇方案一线治疗mPDAC的疗效。罗氏将负责试验的推进,两家公司将平分研究中CEND-1治疗组的费用。
医药热点
1.世卫组织重新命名猴痘病毒分支。世卫组织12日宣布对猴痘病毒分支重新命名,新名称将由罗马数字和小写英文字母组成。世卫组织召集的一个全球专家小组已就猴痘病毒分支的新名称达成一致。新名称将使用罗马数字表示病毒分支,用小写字母表示亚分支。例如,专家们现在将此前刚果盆地分支称为分支Ⅰ,将此前西非分支称为分支Ⅱ。分支Ⅱ又包括两个亚分支,即Ⅱa和Ⅱb,其中Ⅱb是2022年猴痘疫情中主要传播的一组病毒变种。
2.2021中国两类心脏手术数量创新高。2022全国体外循环学术年会(ChSECC2022)主题大会发布《2021年中国心外科手术及体外循环数据调查白皮书》,调查结果显示2021年我国心脏大血管手术量和体外循环手术量双双再创新高,分别达到了278056例和176496例。2021年我国心脏外科手术量超过万例的医院依然是2家,分别是北京安贞医院(14867)和阜外医院(14570);另外还有3家医院超过了5000例,分别是武汉亚洲心脏病医院、复旦大学附属中山医院和广东省人民医院。
2.新型便携式诊断仪可同时检测新冠病毒和抗体。发表在Nature Biomedical Engineering上的一项最新研究显示,来自哈佛大学的科研人员研发出一种明信片大小的新型便携式诊断设备,这款设备可以同时准确检测出感染者唾液样本中的新冠病毒和抗体。这种新冠诊断设备使得我们可以经济且高效地追踪监测人群的病毒感染和体内免疫情况,其准确性水平和实验室测试准确性水平相当。
评审动态
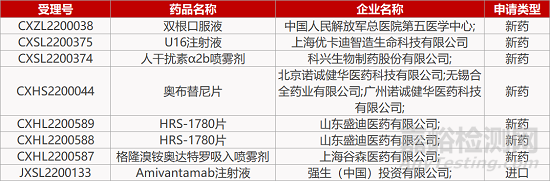
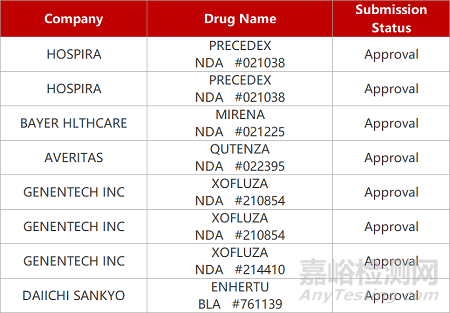

来源:药研发


